
| A、卤代烃在NaOH溶液加热时水解生成的有机物都是醇 |
| B、所有的一元醇都能被氧化为具有相同碳原子数的醛或酮 |
C、 与 与  互为同系物 互为同系物 |
| D、由摩尔质量相等的一元羧酸和一元醇形成的酯C9H18O2的同分异构体共有16种 |
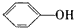 为苯酚,
为苯酚, 为苯甲醇,二者结构不同;
为苯甲醇,二者结构不同; 为苯酚,属于酚类,而
为苯酚,属于酚类,而 为苯甲醇,属于醇类,二者的结构不同,所以一定不属于同系物,故C错误;
为苯甲醇,属于醇类,二者的结构不同,所以一定不属于同系物,故C错误;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | 基态原子核外p能级电子总数比s能级少一个 |
| Z | 由Z形成的多种单质,其中之一是地球生物的“保护伞” |
| W | 含量位居地壳中金属元素的第二位 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3CHHO | HCN | H2CO3 |
| 电离平衡常数(25) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |

| 充电 |
| 放电 |
+ 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出高热值的煤炭气,主要成分是CO和H2.
科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出高热值的煤炭气,主要成分是CO和H2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②和③ | B、②和① |
| C、③和① | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用生物质能就是间接利用太阳能 |
| B、生物质能是可再生的能源 |
| C、生物质能是解决农村能源的重要途径 |
| D、生物质能的缺点是严重污染环境 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com