
| A、7.8g Na2O2中含有的离子总数目为0.4NA |
| B、1mol苯分子中含有碳碳双键数目为3NA |
| C、标准状况下,将分子总数为NA的NH3和HCl气体混合后的体积约为22.4L |
| D、16g CH4与18g NH4+所含电子数均为10NA |


科目:高中化学 来源: 题型:
| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | 消耗NaOH溶液的平均体积(mL) | |
| 滴定前 | 滴定后 | |||
| 1 | 20.00 | 0.00 | 16.26 | |
| 2 | 20.00 | 0.00 | 16.30 | |
| 3 | 20.00 | 0.02 | 16.24 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置可用于定量测定H2O2的分解速率 装置可用于定量测定H2O2的分解速率 |
B、 装置制备Fe(OH)2并能较长时间观察其颜色 装置制备Fe(OH)2并能较长时间观察其颜色 |
C、 装置测量Cu与浓硝酸反应产生气体的体积 装置测量Cu与浓硝酸反应产生气体的体积 |
D、 装置可用于蒸干NH4Cl饱和溶液制备NH4Cl晶体 装置可用于蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4LCO和CO2的混合气体中所含的碳原子数一定是NA |
| B、含1mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2NA |
| C、常温常压下,32g O2和32g O3所含氧原子数都是2NA |
| D、标准状况下,11.2L H2O含有0.5NA分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 操作 | 现象 | 解释 |
| A | FeI2溶液中滴加过量氯水 | 溶液变黄 | 氯水氧化I-成碘单质,碘水呈黄色: 2I-+Cl2=I2+2Cl- |
| B | 苯酚钠溶液中通入少量CO2 | 出现白色浑浊 | 苯酚酸性弱于碳酸,反应生成苯酚: 2C6H5O-+CO2+H2O=2C6H5OH+CO32- |
| C | Ca(HCO3)2溶液中滴加过量NaOH溶液 | 出现白色沉淀 | Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D | 含有等浓度的Mg2+和Cu2+的废水液中逐滴加入少量NaOH溶液调节溶液pH=7 | 溶液中先出现蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2],因此Cu2+先沉淀;Cu2++2OH-=Cu(OH)2↓ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、53g碳酸钠中含NA个CO32- |
| B、0.1molOH-含NA个电子 |
| C、1.8gD2O中含NA个中子 |
| D、11.2L氧气中含NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
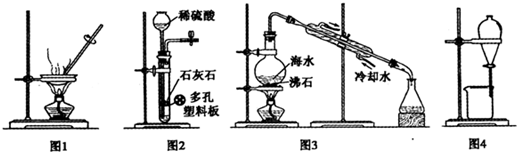
| A、用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体 |
| B、用图2装置制取二氧化碳气体 |
| C、用图3装置蒸馏海水制取少量淡水 |
| D、用图4装置分离乙醇与乙酸乙酯的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使酚酞变红色的溶液:Na+、Ba2+、I-、Cl- | ||
| B、使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42- | ||
C、含有0.1 mol?L-1 Fe3+的溶液:Na+、K+、SCN-、NO
| ||
| D、由水电离产生的c(H+)=10-12mol?L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com