
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某稀醋酸溶液的pH为3.5 | |
| D. | 用0.2000mol•L-1HCl溶液滴定20.00mL未知浓度NaOH,用去22.40mL HCl溶液 |
分析 A.托盘天平的感量为0.1g;
B.量筒能准确到0.1mL;
C.pH试纸测定的pH为正整数;
D.滴定管的读数准确到0.01mL.
解答 解:A.托盘天平的感量为0.1g,则用托盘天平称取11.7g食盐,故A错误;
B.量筒能准确到0.1mL,则用100mL的量筒量取25.0mL盐酸,故B错误;
C.pH试纸测定的pH为正整数,则用pH试纸测得某稀醋酸溶液的pH为3或4,故C错误;
D.滴定管的读数准确到0.01mL,则用0.2000mol•L-1HCl溶液滴定20.00mL未知浓度NaOH,用去22.40mL HCl溶液,数据合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握常见实验仪器的使用、实验基本操作为解答的关键,侧重分析与实验能力的考查,注意数据分析,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:解答题
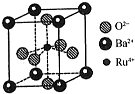 合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.
合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH固体 | B. | 水 | C. | CuSO4固体 | D. | 氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
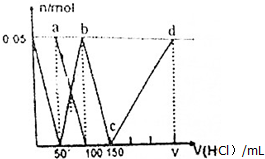
| A. | a点溶液中:c(HCO${\;}_{3}^{-}$)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | 当向混合液中滴加75nL盐酸时,溶液中部分离子浓度大小顺序为:c(Na+)>c(Cl-)>c(CO${\;}_{3}^{2-}$)>c(OH-)>c(H+) | |
| C. | b点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO${\;}_{3}^{2-}$)=1.5mol•L-1 | |
| D. | c→d的过程中水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | 420 | 7 | 9 | ||
| Ⅲ | 探究催化剂对该反应速率的影响 | 10 | 7 | 9 | |
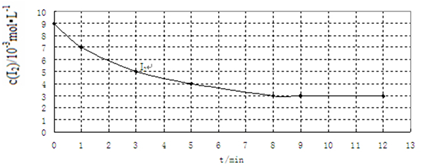
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
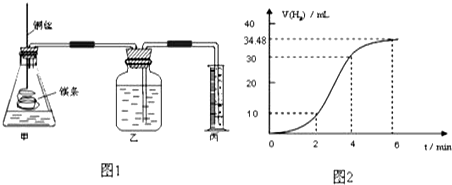
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 振荡混合物,用分液漏斗分离 | |
| B. | 加入NaOH溶液后振荡,用分液漏斗分离;取下层液体通入CO2,待分层后分液 | |
| C. | 加水振荡后用分液漏斗分离 | |
| D. | 加稀盐酸振荡后,用分液漏斗分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com