
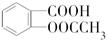
 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下: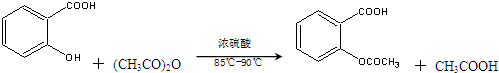
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
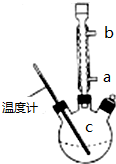
分析 (1)由于乙酸酐与水反应发生水解反应,制备中仪器应干燥;
(2)控制温度在85℃~90℃,温度低于100℃,应采取水浴加热;
(3)①乙酰水杨酸受热易分解,分解温度为128℃~135℃;
②采取逆流原理通入冷凝水,充满冷凝管,充分冷凝回流;
③防止乙酰水杨酸结晶析出;
④利用水杨酸、乙酰水杨酸在乙酸乙酯中溶解度不同就行分离提纯,水杨酸与乙酰水杨酸均含有羧基,且在水中微弱,不能用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸;
(4)计算水杨酸、乙酸酐的物质的量,进行过量判断,根据不足量的物质计算理论产量,进而计算产率.
解答 解:(1)乙酸酐容易发生水解生成乙酸,故仪器应干燥,防止乙酸酐水解,
故答案为:乙酸酐与水反应;
(2)控制温度在85℃~90℃,温度低于100℃,应采取水浴加热,便于控制温度,防止乙酰水杨酸受热易分解,
故答案为:水浴加热;
(3)①乙酰水杨酸受热易分解,分解温度为128℃~135℃,使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解,
故答案为:乙酰水杨酸受热易分解;
②采取逆流原理通入冷凝水,充满冷凝管,充分冷凝回流,冷凝水从a口进,从b口出,
故答案为:a;
③趁热过滤,防止乙酰水杨酸结晶析出,减少损失,
故答案为:防止乙酰水杨酸结晶析出;
④乙酸乙酯起溶剂作用,趁热过滤除去水杨酸,再冷却结晶析出乙酰水杨酸,说明低温时乙酰水杨酸在乙酸乙酯中的溶解度较小,利用水杨酸、乙酰水杨酸在乙酸乙酯中溶解度不同就行分离提纯,这种分离提纯方法为重结晶,由于水杨酸与乙酰水杨酸均含有羧基,且在水中微弱,不能用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸,
故选:abc;
(4)水杨酸的相对分子质量为138,n(水杨酸)=2.0 g÷138g/mol=0.0145mol,n(乙酸酐)=(5.0 mL×1.08 g/cm3)÷102g/mol=0.0529mol,由于乙酸酐的物质的量大于水杨酸,所以得到的乙酰水杨酸应该按照水杨酸来计算,故理论上得到乙酰水杨酸的质量为0.0145mol×180g/mol=2.61g,所以乙酰水杨酸的产率为(2.2g÷2.61g)×100%=84.3%,
故答案为:84.3%.
点评 本题考查有机物制备实验方案设计与评价,注意对题目信息的应用,(3)中注意根据流程理解分离提纯方法,较好的考查学生分析解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
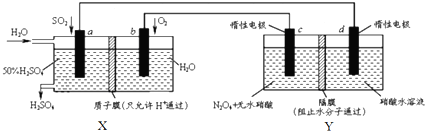
| A. | X是原电池,能够生产硫酸.Y是电解池,能够生产N2O5 | |
| B. | c电极的电极反应方程式为:N2O4+2HNO3-2e-=2N2O5+2H+ | |
| C. | 当电路中通过2mol e-,X、Y中各有1molH+从左边迁移到右边 | |
| D. | 为保证X中硫酸的质量分数不变,则加入的n(so2):n(H2O)=1:7.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子间都以单链相连的链烃是烷烃 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 油与脂肪都属于甘油酯 | |
| D. | 葡萄糖与果糖互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O${\;}_{8}^{2-}$)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
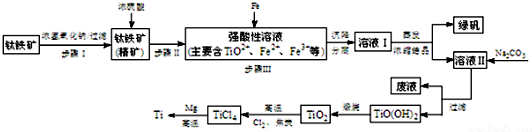
| pH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Ti(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
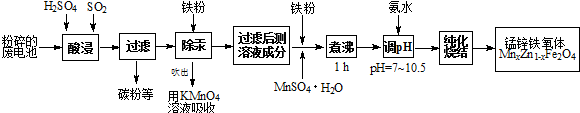
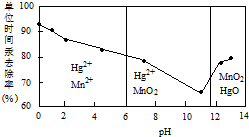
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
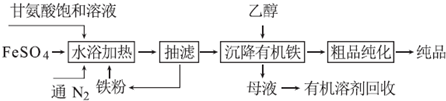
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
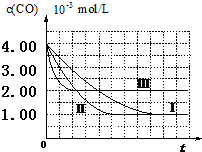 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 120 | |||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com