
| A. | 10g46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| B. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| C. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| D. | 24g3H218O含有的中子数为10NA |
分析 A、乙醇水溶液中溶剂水中含有氢原子,依据乙醇和溶剂水中所含氢原子计算判断;
B、氯气溶于水,只有部分氯气与水反应生成氯化氢和次氯酸,无法计算转移的电子数;
C、根据阳极Cu-2e═Cu2+,电解精炼铜是阳极为粗铜来分析;
D、依据n=$\frac{m}{M}$计算物质的量,结合质量数=质子数+中子数计算;
解答 解:A、10g46%的乙醇水溶液中所含氢原子数目=($\frac{10g×46%}{46g/mol}×6+\frac{10g×54%}{18g/mol}×2$)×NA=1.2NA,故A正确;
B、标准状况下,2.24L氯气的物质的量为0.1mol,由于氯气溶于水后,只有少量的氯气与水反应,反应是可逆反应,转移的电子数目小于0.1NA,无法计算转移的电子的物质的量,故B错误;
C、由Cu-2e═Cu2+,每转移NA个电子时,阳极溶解铜的质量为0.5mol×64g/mol=32g,但阳极材料为粗铜,则阳极溶解铜的质量小于32g,故C错误;
D、24g3H218O物质的量=$\frac{24g}{24g/mol}$=1mol,中子数=1mol[2×(3-1)+18-8]×NA=14NA,故D错误;
故选A.
点评 本题考查有关物质的量及阿伏伽德罗常数的计算,明确电子数等于质子数、质量数=质子数+中子数、电极反应式及电极材料是解答的关键,并注意可逆反应不能进行彻底来解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
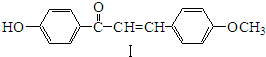

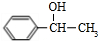 ,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为
,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为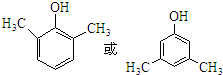 (任写一种).
(任写一种).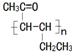 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为 ,
,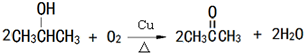 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
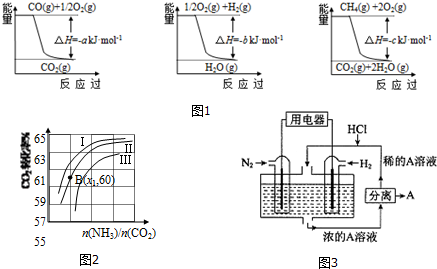
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
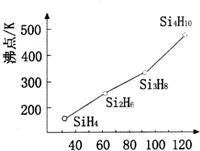 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgI浊液中滴入NaCl溶液,产生大量白色沉淀:AgI(s)+Cl-(aq)=AgCl(s)+I-(aq) | |
| B. | 用氨水除去铝片表面的氧化膜:Al2O3+2NH3•H2O=2AlO2-+2NH4++H2O | |
| C. | 用铁氰化钾溶液检验Fe2+:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ | |
| D. | 向酸性KMnO4溶液中滴入过氧化氢产生无色气泡:2MnO4-+9H2O2+6H+=2Mn2++7O2↑+12H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价为+6 | B. | 简单离子半径的大小顺序:X>Y>Z | ||
| C. | 简单气态氢化物的稳定性:X>Y | D. | 元素X和Y能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com