
【题目】下列关于原子的几种描述中,不正确的是( )
A. 15N与14N具有相同的质子数 B. 12C与13C具有相同的质量数
C. 16O与17O具有相同的电子数 D. 18O与19F具有相同的中子数
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】如图是中学化学常用的实验仪器: 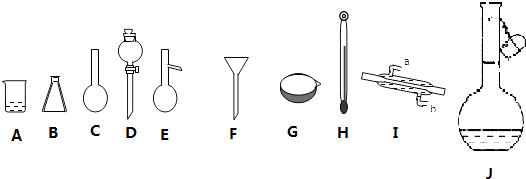
(1)填写以下仪器的名称:C , G .
(2)分离由乙醇和甘油组成的混合物需要用到的上述仪器有(填序号,下同)(已知乙醇和甘油互溶,沸点:乙醇78.5℃,甘油259℃);标有使用温度的仪器是 .
(3)填写除去下列混合物中的杂质需要的操作方法(括号内为杂质): NaCl溶液(泥沙); NaCl溶液(汽油);氯化钠固体(碘) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g)![]() CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
A. 单位时间内消耗2 mol的CO同时生成2 mol的CO2
B. 两个H—O键断裂的同时有一个H—H键断裂
C. 反应容器内的压强不再发生变化
D. 混合气体的相对分子质量不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1) 某浓度的氨水中存在平衡:NH3·H2O ![]() NH4+ + OH-,如想增大NH4+的浓度而不增大OH-的浓度,可采取的措施是___________填字母)。
NH4+ + OH-,如想增大NH4+的浓度而不增大OH-的浓度,可采取的措施是___________填字母)。
a.适当升高温度 b.加入NH4Cl固体
c.通入NH3 d.加入少量浓盐酸
(2) 常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,两溶液中的c(H+)变化情况是:
醋酸溶液中c(H+) _____________________(填“增大”、“减小”或“不变”),盐酸溶液中c(H+) __________________(填“增大”、“减小”或“不变”)
②加水稀释10倍后:醋酸溶液中的c(H+)________盐酸溶液中的c(H+)(填“>”、“=”或“<”)。
③加等浓度的NaOH溶液至恰好中和,所消耗的NaOH溶液体积相比较:醋酸_____________盐酸(填“>”、“=”或“<”)。
④使温度都升高20 ℃后,两溶液中c(H+)比较:醋酸____________盐酸(填“>”、“=”或“<”)。
⑤ 分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_________________(填字母,①代表盐酸,②代表醋酸溶液)。

(3) 将0.1 mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是_________________ (填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2+3H22NH3 , 在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
A.v(H2)=0.03 mol/(Lmin)
B.v(N2)=0.02 mol/(Lmin)
C.v(NH3)=0.17 mol/(Lmin)
D.v(NH3)=0.01 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大.X的一种核素没有中子,Y是有机物的主要组成元素,L和M分别是地壳中含量最高的非金属元素和金属元素.回答下列问题:
(1)L的元素符号为;M在元素周期表中的位置为;Z元素的最高正价和最低负价分别为、 , 它的氢化物和最高价氧化物对应水化物反应的化学方程式为 .
(2)Z、X两元素按原子数目比l:3和2:4构成分子A和B,A的电子式为 , B的结构式为 .
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子原子结构示意图为 .
(4)五种元素的原子半径从大到小的顺序是(用元素符号表示).
(5)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子: .
(6)写出由X、Z、L三种元素组成的离子化合物与稀NaOH溶液反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中常用铝制炊具,它质轻且坚固耐用,其中的原因是( )
A.铝很不活泼,不易与其他物质反应
B.铝虽然很活泼,但是只有在高温下才能与其他物质反应
C.铝制品表面有一层致密的氧化物薄膜,起保护作用
D.铝制品表面镀有一层铜,可以保护铝制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:电池:Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)。电解池:2Al+3H2O![]() Al2O3+3H2↑,电解过程中,以下判断正确的是
Al2O3+3H2↑,电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb O2电极 | H+移向Pb电极 |
B | 每消耗3mol Pb | 生成2 mol Al2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1molL—1二元弱酸H2A溶液的pH,溶液中的H2A、HA—、A2—的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=c(x)/(c(H2A)+c(HA—)+c(A2—)])。下列叙述正确的是

A. Ka2(H2A)的数量级为10-4
B. NaHA溶液中,HA-的水解能力小于HA-的电离能力
C. 在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,δ(HA-)一定增大
D. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中δ(HA-)=δ(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com