
| A. | 聚四氟乙烯的化学活动性很强 | B. | 聚四氟乙烯分子中含有双键 | ||
| C. | 聚四氟乙烯的单体是不饱和烃 | D. | 聚四氟乙烯中氟的质量分数是76% |
分析 A、聚四氟乙烯的涂层用不粘锅烹烧饭菜时不易粘锅、烧焦,说明聚四氟乙烯不活泼;
B、聚四氟乙烯的结构式为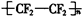 ,分子中没有双键;
,分子中没有双键;
C、烃是仅由碳和氢两种元素组成的有机化合物;
D、根据聚四氟乙烯的化学式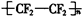 求含氟的质量分数.
求含氟的质量分数.
解答 解:A、不粘锅的内壁有一层聚四氟乙烯的涂料,说明该物质应该是一种化学活泼性不强的物质,故A错误;
B、聚四氟乙烯的结构式为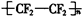 ,不含有双键,故B错误;
,不含有双键,故B错误;
C、聚四氟乙烯的单体是四氟乙烯,四氟乙烯含有氟元素,不是烃,是烃的衍生物,故C错误;
D、聚四氟乙烯的化学式(CF2CF2)m中含氟的质量分数为$\frac{19×4m}{100m}$×100%=76%,故D正确;故选D.
点评 本题考查利用物质的化学式可判断物质的组成及分子构成,可计算物质组成元素的质量分数;利用物质的用途可推断物质的性质,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
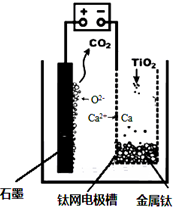 工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O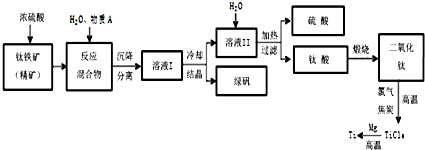
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
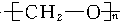 ,它是通过加聚反应制得的,则合成象牙的单体是( )
,它是通过加聚反应制得的,则合成象牙的单体是( )| A. | (CH3)2O | B. | CH3CHO | C. | HCHO | D. | C2H2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电池的总反应式:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2 | |
| B. | 电池充电时,镉元素被还原 | |
| C. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| D. | 电池充电时,电池的负极和电源的正极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com