
【题目】I某钙钛矿型太阳能电池吸光材料的晶胞结构如图所示,其中A通常为CH3NH3+,可由甲胺(CH3NH2)制得;M为Pb2+或Sn2+;X为卤离子,如Cl-、Br-等。
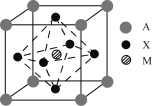
(1)吸光材料的化学式为___(用A、X、M表示)。
(2)H、C、Cl三种元素的电负性由小到大的顺序为____。
(3)溴原子基态核外价电子排布式为___。
(4)甲胺(CH3NH2)极易溶于水,除因为它们都是极性分子外,还因为___。
(5)CH3NH2中N原子的轨道杂化类型为__;1mol CH3NH3+中含σ键的数目为____。
II 镍的单质、合金及其化合物用途非常广泛。
(1)Ni在周期表中的位置为___。
(2)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4的熔沸点比C2H6高的多的原因是____;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为_____。
(3)一种新型的功能材料的晶胞结构如图所示,它的化学式可表示为___。每个Mn周围最近且等距离的Mn数目为___,每个Ga周围最近且等距离的Mn数目为____。
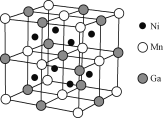
【答案】AMX3 H<C<Cl 4s24p5 CH3NH2与H2O形成分子间氢键 sp3 7mol或7×6.02×1023 第四周期VIII族 N2H4分子间可以形成氢键 ![]() Ni2MnGa 12 6
Ni2MnGa 12 6
【解析】
I (1) 该晶胞中A微粒个数=8×![]() =1、X微粒个数=6×
=1、X微粒个数=6×![]() =3、M微粒个数=1,其化学式为AMX3;
=3、M微粒个数=1,其化学式为AMX3;
(2)元素的非金属性越强,其电负性越大,非金属性CI>C>H,则电负性H<C<C1;
(3) Br原子核外有35个电子,根据构造原理书写该原子核外电子排布式为[Ar]3ds104s24p5;
(4)能和水形成氢键的溶质溶解性较大,CH3NH2与H2O形成分子间氢键,所以甲胺极易溶于水;
(5)N原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断N原子轨道杂化方式为sp3;该微粒中含有7个σ键,1 mol CH3NH3+中含σ键的数目为7 mol或7×6.02×1023 ;
II(1)Ni的原子序数为28,在周期表中的位置为第四周期VIII族;
(2)[Ni(N2H4)2](N3)2是一种富氮含能材料。N2H4分子间可以形成氢键,故配体N2H4的熔沸点比C2H6高得多;Ni2+提供空轨道,N2H4中N原子提供孤对电子,形成配位键, [Ni(N2H4)2]2+的结构可用示意图表示为![]() ;
;
(3) Ni原子处于小立方体体心,晶胞中Ni原子数目=8,Mn原子处于顶点与面心,晶胞中Mn原子数目=8×![]() +6×
+6×![]() =4,Ga处于晶胞体心与棱心,晶胞中Ga原子数目=1+12×
=4,Ga处于晶胞体心与棱心,晶胞中Ga原子数目=1+12×![]() =4,则晶胞中Ni、Mn、Ga原子数目之比=8: 4: 4=2: 1: 1,故晶体的化学式为: Ni2MnGa;
=4,则晶胞中Ni、Mn、Ga原子数目之比=8: 4: 4=2: 1: 1,故晶体的化学式为: Ni2MnGa;
根据晶胞的结构可知,每个Mn周围最近且等距离的Mn数目为12,每个Ga周围最近且等距离的Mn数目为6。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示,下列说法不正确的是
C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示,下列说法不正确的是
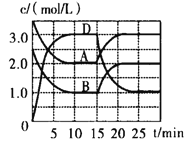
A. 反应在前10min的平均反应速率v(B)=0.15mol/(L·min)
B. 该反应的平衡常数表达式K=![]()
C. 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D. 反应至15min时,改变的反应条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化剂与还原剂的判断正确的是( )
A. 反应CH4+2O2![]() CO2+2H2O中,O2是氧化剂,CH4是还原剂
CO2+2H2O中,O2是氧化剂,CH4是还原剂
B. 反应Cl2+2NaOH===NaClO+NaCl+H2O中,Cl2是氧化剂,NaOH是还原剂
C. 反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
D. 反应2Na+2H2O===2NaOH+H2↑中,H2O既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在500 ℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3 和SO2)。下列说法正确的是
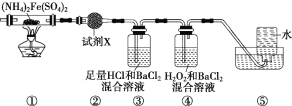
A. 取装置①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
C. 装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3
D. 装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解H2和O2,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是( )
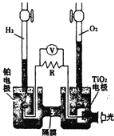
A.该装置可以将光能转化为电能,同时也能转化为化学能
B.铂电极上发生的反应为:H2-2e-=2H+
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”.
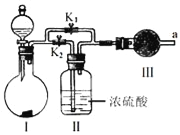
(1)过氧化钠与水反应的化学方程式是__.
(2)装置I是制备纯净的__(填化学式).则装置I中最适宜的试剂组合是__(填字母).
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2.
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃.
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是__;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
A. 标准状况下,11.2LCH2Cl2中所含C-Cl键的数目与22.4LHF中所含F原子数目相等
B. 1LpH=13的NaOH溶液中含有OH-的数目一定为0.1NA
C. 1mol过氧化钠分别与足量CO2、SO2反应,转移的电子数均为2NA
D. 10g质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com