
【题目】[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
【答案】(1)[Ar]3d9;N>O>S;(2)正四面体,CCl4(或SiF4等);(3)sp2,配位键、离子键;(4)CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;(5)①(![]() ;
;![]() ;
;![]() ),Cu;②
),Cu;②![]() 。
。
【解析】
试题分析:(1)阳离子是Cu2+,Cu元素位于第四周期IB族,元素基态原子核外电子排布式为[Ar]3d104s1,因此Cu2+基态核外电子排布式为:[Ar]3d9;同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,非金属性越强,第一电离能越大,即第一电离能大小顺序是N>O>S;(2)SO42-价层电子对数为SO42-价层电子对数为为4+(6+2-4×2)/20=4,因此SO42-立体结构是正四面体,等电子体:价电子总数相等,原子总数相等的微粒,因此S符合条件的是CCl4或SiF4等;(3)NO3-中N有3个σ键,孤电子对数(5+1-2×3)/2=0,杂化类型等于价层电子对数,即N的杂化类型为sp2,含有化学键为离子键、配位键;(4) CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;(5)①根据各个原子的相对位置可知,D在各个方向的1/4处,所以其坐标是(![]() ;
;![]() ;
;![]() ),根据均摊法,白球的个数为(8×1/8+1)=2,灰球位于体心,灰球有4个,因此化学式为Cu2O,灰球是Cu;②晶胞质量为2×144/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义,阿伏加德罗常数=
),根据均摊法,白球的个数为(8×1/8+1)=2,灰球位于体心,灰球有4个,因此化学式为Cu2O,灰球是Cu;②晶胞质量为2×144/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义,阿伏加德罗常数=![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如下所示:
FeCl3·6H2O![]() FeOOH
FeOOH![]() 纳米四氧化三铁
纳米四氧化三铁
下列有关叙述不合理的是( )
A.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
B.纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径大小相等
C.在反应①中环丙胺的作用可能是促进氯化铁水解
D.反应②的化学方程式是6FeOOH+CO===2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为2mol/LAgNO3与Cu(NO3)2溶液各0.5L混合,以铜电极进行电解,一段时间后,阴极上有1.6g铜析出。
(1)直流电源已输出__mol电子。
(2)溶液中c(Cu2+)为_mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用实验室制得的乙烯(C2H5OH![]() CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是

A. 装置①和装置③中都盛有水,其作用相同
B. 装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C. 产物可用分液的方法进行分离,1,2﹣二溴乙烷应从分液漏斗的上口倒出
D. 制备乙烯和生成1,2﹣二溴乙烷的反应类型分别是消去反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是( )
A. 实验时的温度T2高于T1
B. 2号Cu2O的催化效率比1号Cu2O的催化效率高
C. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1
D. 等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物)。1mol某芳香烃A充分燃烧后可得到8molCO2和4molH2O。该烃A在不同条件下能发生如图所示的一系列变化。
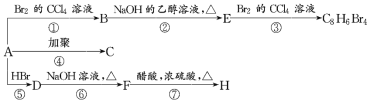
(1)A的化学式:______,A的结构简式:______。
(2)上述反应中,①是______ (填反应类型,下同)反应,⑦是______反应。
(3)写出C、D、E、H的结构简式:
C______,D______,E______,H______。
(4)写出反应D→F的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,两种气态烃以任意比混合,1L混合烃与9LO2混合,充分燃烧后恢复到原状态,所得气体体积仍为10L。下列各组混合烃不符合此条件的是( )
A.CH4和C2H4B.CH4和C3H4
C.C2H2和C3H6D.C2H4和C3H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铟(In2O3)是一种透明的导电材料,可运用于接触屏、液晶显示器等高科技领域;铟产业被称为“信息时代的朝阳产业”。利用水铟矿[主要成分In(OH)3,常温下Ksp[In(OH)3]=l.41×10-33]制备In2O3的工艺流程如下:
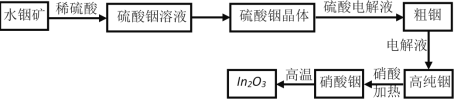
(1)写出水铟矿被硫酸酸浸的离子方程式___________________。
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:____、_____、过滤、洗涤、干燥。
(3)某研究机构用硫酸提取铟时,酸度(每升溶液中含硫酸的质量)与浸出率关系如图
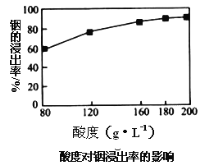
①当酸度为196时,硫酸物质的量浓度为___________。
②请选择适宜的酸度值:_______,并说明选择的理由______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 为核电荷数小于18的两种元素,元素
为核电荷数小于18的两种元素,元素![]() 的原子的最外层电子数是次外层电子数的一半,元素
的原子的最外层电子数是次外层电子数的一半,元素![]() 的原子的最外层电子数与最内层电子数之和等于次外层电子数。下列有关叙述正确的是
的原子的最外层电子数与最内层电子数之和等于次外层电子数。下列有关叙述正确的是
A.![]() 、
、![]() 一定是非金属元素B.
一定是非金属元素B.![]() 的最外层电子数比
的最外层电子数比![]() 的少
的少
C.![]() 的单质在化学反应中只能作还原剂D.
的单质在化学反应中只能作还原剂D.![]() 与
与![]() 的最外层电子数相等
的最外层电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com