
 2SO3,标况下,三氧化硫为固体,根据气体体积差,利用差量法计算参加反应二氧化硫的体积,进而计算参加反应二氧化硫物质的量、生成三氧化硫的物质的量,根据m=nM计算参加反应二氧化硫的质量、生成三氧化硫的质量,反应后的气体通过氢氧化钠溶液,二氧化硫被吸收,即反应后二氧化硫为2.00g,进而计算原混合气体中二氧化硫的质量.
2SO3,标况下,三氧化硫为固体,根据气体体积差,利用差量法计算参加反应二氧化硫的体积,进而计算参加反应二氧化硫物质的量、生成三氧化硫的物质的量,根据m=nM计算参加反应二氧化硫的质量、生成三氧化硫的质量,反应后的气体通过氢氧化钠溶液,二氧化硫被吸收,即反应后二氧化硫为2.00g,进而计算原混合气体中二氧化硫的质量. 2SO3 体积减少△V
2SO3 体积减少△V| 2×80mL |
| 3 |
| 160 |
| 3 |
| ||
| 22.4L/mol |
| ||
| 22.4L/mol |
| ||
| 22.4L/mol |


科目:高中化学 来源: 题型:
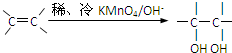 .请写出A与稀、冷的KMnO4溶液在碱性
.请写出A与稀、冷的KMnO4溶液在碱性查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体中一定有乙烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中可能有丙烯 |
| D、混合气体中一定没有乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此白色固体为KOH和K2CO3的混合物 |
| B、此白色固体中含有K2CO3 6.90g |
| C、原KOH溶液中的物质的量浓度是0.500 mol?L-1 |
| D、此白色固体KHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com