
氨气在科研、生产中有广泛应用。
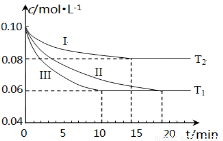
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g) 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)= ;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为 、 。
(2)常温下NH4+(aq)+H2O(l) NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。
NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。
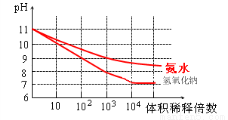
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+ (g) ΔH2= 。
(1)①v(N2)= Δ c (N2) /Δt=(0.10-0.06 )mol·L-1/10min=0.004(或4×10-3) mol·L-1·min-1(代数式1分,结果表达1分,带单位运算1分。共3分) ②升高温度、使用催化剂(各2分,共4分)
(2)1.80×10-5mol·L-1(2分,无单位扣1分)。
(3)(见右图)(2分)
(4)6NO(g)+4NH3(g)=5N2(g)+6H2O(g) (2分)ΔH2=-720 kJ/mo1。(2分,没负号扣1分)
或者3NO(g)+2NH3(g)=5/2N2(g)+3H2O(g) ΔH2=-360 kJ/mo1
【解析】
试题分析: (1)①从图像可以看出10分钟内氮气的变化量,因此反应速率v(N2)=Δ c (N2) /Δt=(0.10-0.06 )mol·L-1/10min=0.004(或4×10-3) mol·L-1·min-1 ;
②与实验II相比,曲线I更快达到平衡,但氮气的平衡转化率要低,而该反应是吸热反应,因此改变的条件应该是升高了反应的温度;与实验II相比,曲线III反应速率也更快达到平衡,但是平衡转化率不同,因此改变的条件应该是加入了催化剂。
(2)已知的反应式为NH4+ 的水解平衡式,该反应式可以由水的电力平衡式和氨水的电离平衡式结合而得,因此现在要求氨水的电离平衡,只要用水的电力平衡式H2O(l) H+(aq)+OH-(aq)减去已知的水解平衡式即可,相应的平衡常数K(NH3?H2O)=Kw/Kh=1×10-14 /5.55×10-10 =1.80×10-5 mol·L-1 。
H+(aq)+OH-(aq)减去已知的水解平衡式即可,相应的平衡常数K(NH3?H2O)=Kw/Kh=1×10-14 /5.55×10-10 =1.80×10-5 mol·L-1 。
(3)pH相同的弱碱和强碱溶液稀释,前阶段强碱溶液的pH值等倍数的降低,弱碱溶液边稀释边电离pH降低比强碱要慢,后阶段稀释接近无限稀释,因此溶液的pH值均不再等倍数降低,而是无限的接近7,但是碱溶液始终是碱溶液,pH值不能等于7。因此曲线如图所示。

(4)用氨气做还原剂还原污染物NO,此处氨气中N的化合价由-3→0价,NO中N的化合价由+2→0价,因此根据得失电子守恒配平方程式为6NO(g)+4NH3(g)=5N2(g)+6H2O(g),方程式中NO的系数是6,表示还原NO为6mol,因此热效应ΔH2=6×120kJ=720kJ/mol。由于热化学方程式中系数可以是分数,因此答案也可以是3NO(g)+2NH3(g)=5/2N2(g)+3H2O(g) ΔH2=-360 kJ/mo1。
考点:本题考查的是化学反应原理的知识。


科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.氯气通入水中:Cl2 + H2O  2H+ + Cl-+ClO-
2H+ + Cl-+ClO-
B.氢氧化铁胶体中加入HI溶液:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C.NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O = 2Al(OH)3↓+ CO32-
D.用稀硝酸除去试管内壁银:3Ag+ 4H+ + NO3- = 3Ag+ + NO↑ +2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.78 g 苯含有碳碳双键的数目为3NA
B.常温常压下,22.4 L二氧化碳含有的原子总数为3NA
C.1 mol Fe与足量稀HNO3反应,转移3 NA个电子
D.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省清远市高三4月模拟理综化学试卷(解析版) 题型:填空题
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
①CH4 (g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH=-570 kJ·mol-1
②CH4(g)+4NO(g)==2 N2(g) +CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
则CH4 (g)+2NO2(g)== N2(g)+CO2(g)+2H2O(g) ΔH=___________。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见下图: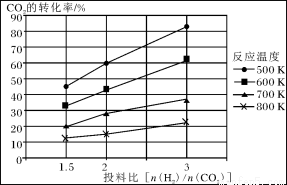

①此反应为 (填“放热”、“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池正极的电极反应式_______________________。
③在a MPa和一定温度下,将6 mol H2和2 mol CO2在2 L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即1/6),此时CO2的转化率是多少?(计算结果保留2位有效数字)
④在a MPa和500K下,将10mol H2和5 mol CO2在2 L密闭容器中混合,5min达到平衡,请在答题卡的坐标图中画出H2浓度变化图。(请标出相应的数据)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省清远市高三4月模拟理综化学试卷(解析版) 题型:选择题
下列各组离子在通入SO2前后均能大量共存的是
A.Ba2+、K+、Br-、Cl- B.Na+、Cu2+、OH-、SiO32-
C.NH4+、Al3+、Br-、AlO2- D.Li+、H+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省深圳市高三第二次调研考试理综化学试卷(解析版) 题型:选择题
常温下,下列有关物质的量浓度关系正确的是( )
A.等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH
B.pH相同的溶液中:c(Na2CO3)<c(NaHCO3)
C.在Na2SO3溶液中:c(Na+)= 2c(SO32-)+ c(HSO3-)+ c(OH-)
D.0.1mol·L-1NaHS溶液中:c(Na+)= c(HS-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:填空题
氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应: C(s)+ H2O(g) 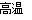 CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH =__________ ___。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
容 器 | 甲 | 乙 | 丙 |
反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
达到平衡的时间(min) | t | 5 | 8 |
平衡时N2的浓度(mol·L-1) | c1 | 3 |
|
N2的体积分数 | ω1 | ω2 | ω3 |
混合气体密度(g·L-1) | ρ1 | ρ2 |
|
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________.
a.2c1 =3mol/L b.ω1 = ω2 c.2ρ1 = ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:选择题
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH—2e—→X+2H+.下列说法中正确的是( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2+4e—+2H2O=4OH—
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH + O2→2CH3CHO + 2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:填空题
镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用。
(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作_____(填“氧化”“还原”)剂,每有1mol H2O2参加反应,转移电子的物质的量为_____。
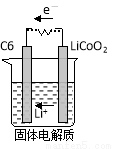
(2)某锂离子电池含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+ C6 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
(3)自然界Cr主要以三价Cr和六价Cr的形式存在。六价Cr能引起细胞的突变和癌变。可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:__Cr2O72-+__SO32-+__H+=__Cr3++__SO42-+ __ ____
(4)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得。操作步骤如下:
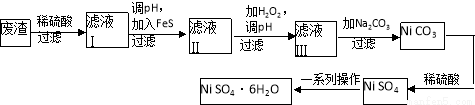
 向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为______________________。
向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为______________________。
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为__________________,调节pH的目的是______________________。
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的是______________________。
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作_____极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com