
| A. | 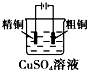 铜的冶炼 | B. | 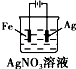 铁上镀银 | C. | 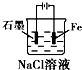 防止Fe被腐蚀 | D. | 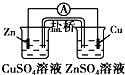 构成铜锌原电池 |
分析 A、铜的冶炼,粗铜的精炼中粗铜作阳极;
B、铁片镀银,铁片应作阴极;
C、电解池中阴极被保护;
D、含有盐桥的原电池中,同一半反应装置中电极材料和电解质溶液中的金属阳离子是相同的元素.
解答 解:A、与电源负极相连的为阴极,粗铜的精炼中粗铜作阳极,由图可知,粗铜作阴极,故A错误;
B、铁片镀银,铁片应作阴极,银座阳极,硝酸银做电解质溶液,图中铁做阳极,故B错误;
C、铁做电解池的阴极,被保护,故C正确;
D、该装置中,同一半反应装置中电极材料和电解质溶液中的金属阳离子不是相同的元素,故D错误;
故选C.
点评 本题考查原电池与电解原理的应用,明确正负极与阴阳极的判断及发生的电极反应是解答本题的关键,注意电解池中如果较活泼的金属作阳极,电解池工作时,阳极上金属失电子而不是溶液中阴离子失电子,难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 破坏生成物全部化学键所需要的能量小于破坏反应物全部化学键所需要的能量时,反应为放热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,即△H>0,反应吸热 | |
| D. | △H的大小与热化学方程式的化学计量数无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 | |||||
| (×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的浓度为0.4 mol•L-1 | B. | X2、Z的浓度均为0.15 mol•L-1 | ||
| C. | X2与Z的浓度之和为0.4 mol•L-1 | D. | X2的浓度为0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 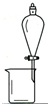 用CCl4提取溴水中的Br2 用CCl4提取溴水中的Br2 | B. | 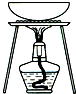 从KI和I2的固体混合物中回收I2 从KI和I2的固体混合物中回收I2 | ||
| C. | 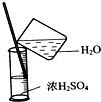 稀释浓硫酸 稀释浓硫酸 | D. | 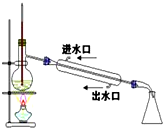 工业酒精制备无水酒精 工业酒精制备无水酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SiO3、H2S、CO2 | B. | H2O、NH3•H2O、HClO | ||
| C. | H2SO3、Ba(OH)2、BaSO4 | D. | Cu(OH)2CH3COOH、C2H5OH、CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com