
| A. | 乙烷 | B. | 丙烷 | C. | 正丁烷 | D. | 异戊烷 |
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.
R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.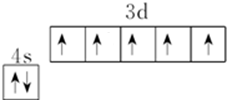 ;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.
;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烷(乙烯):通过盛有溴水的洗气瓶 | |
| B. | KNO3(NaCl):溶解,蒸发结晶,趁热过滤 | |
| C. | 溴苯(溴):加入氢氧化钠溶液,然后分液 | |
| D. | 乙醇(水):加入浓硫酸,然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

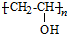 、CH3CH2CH2CHO.
、CH3CH2CH2CHO. .
.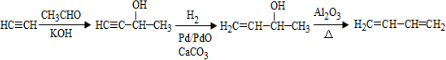 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com