
【题目】随着人们的物质生活水平的不断提高和工业化快速发展,环境污染也日益加重,空气中有毒气体主要包括SO2、CO、NOx、烃类等等。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和水。已知CH4和S的燃烧热ΔH分别为-890 kJ/mol和-297kJ/mol,则CH4和SO2反应的热化学方程式为_______________。
(2)在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
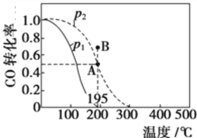
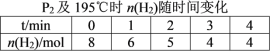
①P2及195℃下,在B点时,v(正)_____v(逆)(填“>”、“<”或“=”)。
②该反应的ΔH_________0(填“>”、“<”或“=”),原因是______________________________。
③在0~2 min,平均反应速率v(H2)=______________________。(数值用小数形式表示)
④在P2及195 ℃时,该反应的平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果用含P2的分式表示)。
(3)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见图所示。
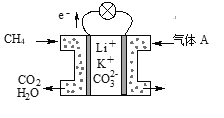
①气体A中除了O2外,一定还含有的气体是________。
②该电池的负极反应式为__________________________。
【答案】CH4 (g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H= -296 kJ/mol < < 其他条件不变时,升高温度,一氧化碳的转化率降低,平衡向逆反应方向移动,说明逆反应方向为吸热,正反应方向放热 0.075 mol·L-1 ·min-1 ![]() CO2或二氧化碳 CH4-8e-+4CO32-=5CO2+2H2O
CO2或二氧化碳 CH4-8e-+4CO32-=5CO2+2H2O
【解析】
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol ①
S(s)+O2(g)=SO2(g) ΔH=-297kJ/mol ②
将①-2×②即得CH4和SO2反应的热化学方程式。
(2)①在B点时,CO的转化率有向A转化的趋势,则由CO的转化率的变化,可推出平衡移动的方向,从而得出v(正)与v(逆)的关系。
②由图中数据可以看出,升高温度,CO的转化率减小,则可推出平衡移动的方向及ΔH。
③在0~2 min,平均反应速率v(H2)=![]() 。
。
④在P2及195 ℃时,三段式关系为:
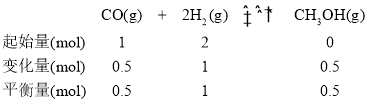
该反应的平衡常数Kp=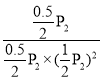 。
。
(3)①气体A中O2+4e-=2O2-,O2-最终将转化为CO32-,二者的差值为CO2。
②该电池的负极为CH4失电子,需要结合CO32-才能中和电性,生成CO2和H2O。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol ①
S(s)+O2(g)=SO2(g) ΔH=-297kJ/mol ②
将①-2×②即得:CH4 (g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H= -296 kJ/mol。答案为:CH4 (g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H= -296 kJ/mol;
(2)①在B点时,CO的转化率有向A转化的趋势,则CO的转化率减小,平衡逆向移动,v(正)<v(逆)。答案为:<;
②升高温度,CO的转化率减小,平衡逆向移动,则该反应的ΔH<0,原因是其他条件不变时,升高温度,一氧化碳的转化率降低,平衡向逆反应方向移动,说明逆反应方向为吸热,正反应方向放热。答案为:<;其他条件不变时,升高温度,一氧化碳的转化率降低,平衡向逆反应方向移动,说明逆反应方向为吸热,正反应方向放热;
③在0~2 min,平均反应速率v(H2)=![]() =0.075 mol·L-1 ·min-1。答案为:0.075 mol·L-1 ·min-1;
=0.075 mol·L-1 ·min-1。答案为:0.075 mol·L-1 ·min-1;
④在P2及195 ℃时,三段式关系为:
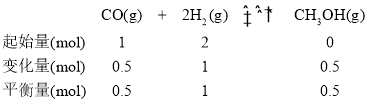
该反应的平衡常数Kp=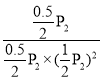 =
=![]() 。答案为:
。答案为:![]() ;
;
(3)①气体A中O2+4e-=2O2-,O2-最终将转化为CO32-,二者的差值为CO2,从而得出一定还含有的气体是CO2。答案为:CO2;
②该电池的负极为CH4失电子,需要结合CO32-才能中和电性,生成CO2和H2O,电极反应式为CH4-8e-+4CO32-=5CO2+2H2O。答案为:CH4-8e-+4CO32-=5CO2+2H2O。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)![]() 2NO2(g),若N2O4的浓度由0.1mol·L-1降到0.07mol·L-1需要15s,那么N2O4的浓度由0.07mol·L-1降到0.05mol·L-1所需的反应时间( )
2NO2(g),若N2O4的浓度由0.1mol·L-1降到0.07mol·L-1需要15s,那么N2O4的浓度由0.07mol·L-1降到0.05mol·L-1所需的反应时间( )
A.等于5sB.等于10sC.小于10sD.大于10s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线![]() 部分反应条件略去
部分反应条件略去![]() 如图所示:
如图所示:
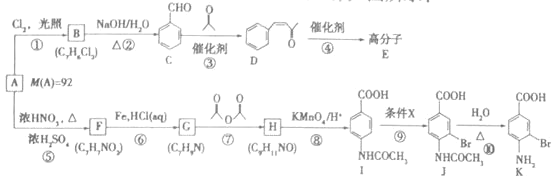
已知:
![]() 同一个碳原子上连两个羟基时不稳定,如
同一个碳原子上连两个羟基时不稳定,如
i.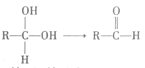 ii.
ii.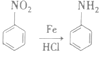
回答下列问题:
![]() 的名称是___________,I含有的官能团是____________。
的名称是___________,I含有的官能团是____________。
![]() 写出反应
写出反应![]() 的化学方程式:___________________。
的化学方程式:___________________。
![]() 的反应类型是_____________,
的反应类型是_____________,![]() 的反应类型是_____________。
的反应类型是_____________。
![]() 分子中最多有_____________个原子共平面,条件X为_______________。
分子中最多有_____________个原子共平面,条件X为_______________。
![]() 写出一种同时符合下列条件的F的同分异构体的结构简式____________________。
写出一种同时符合下列条件的F的同分异构体的结构简式____________________。
![]() 苯环上只有两种不同化学环境的氢原子
苯环上只有两种不同化学环境的氢原子
![]() 既能与银氨溶液反应又能与NaOH溶液反应
既能与银氨溶液反应又能与NaOH溶液反应
![]() 分子中只存在一个环状结构
分子中只存在一个环状结构
![]() 参照上述合成路线,设计一条由D为起始原料制备
参照上述合成路线,设计一条由D为起始原料制备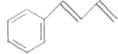 的合成路线
的合成路线![]() 无机试剂及溶剂任选
无机试剂及溶剂任选![]() 。__________________
。__________________
示例流程图如下: CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:
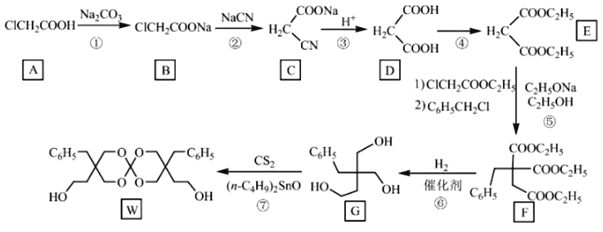
回答下列问题
![]() 的化学名称为__________。
的化学名称为__________。
![]() 的反应类型是_______________。
的反应类型是_______________。
![]() 写出反应
写出反应![]() 方程式_________________________________。
方程式_________________________________。
![]() 的分子式为________________。
的分子式为________________。
![]() 中含氧官能团的名称是_________________。
中含氧官能团的名称是_________________。
![]() 写出与E互为同分异构体的酯类化合物的结构简式______
写出与E互为同分异构体的酯类化合物的结构简式______![]() 符合下列要求,写出其中一个即可
符合下列要求,写出其中一个即可![]()
![]() 核磁共振氢谱为两组峰,峰面积比为1:
核磁共振氢谱为两组峰,峰面积比为1:![]()
![]() 苯乙酸苄酯
苯乙酸苄酯![]()
![]()
![]() 是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线_____________________________
是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线_____________________________![]() 无机试剂任选
无机试剂任选![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧ag乙炔(C2H2)气体时生成1mol二氧化碳和液态水,并放出热量bkJ,则下列乙炔燃烧的热化学方程式书写正确的是( )
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-4bkJ·mol-1
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=2bkJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH=2bkJ·mol-1
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2bkJ·mol-1
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=4bkJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质的量关系如图所示,下列说法正确的是

A. C(s)+2H2(g)=CH4(g) ΔH=-74.8kJ/mol
B. CH4(g)+2O2(g)=CO2(g)+2H2O(1) ΔH=890.3kJ/mol
C. 2H2(g)+O2(g)=2H2O(1) ΔH=-74.8kJ/mol
D. E1在数值上等于1mol CH4的总键能与2mol H2总键能的差值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,含较高浓度的![]() ,可向溶液中同时加入Cu和
,可向溶液中同时加入Cu和 ![]() ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去![]() ,反应原理如下:
,反应原理如下:![]() ;
;![]() ;室温时,实验测得电解液pH对溶液中残留
;室温时,实验测得电解液pH对溶液中残留![]() 的影响和平衡时溶液中相关离子浓度的关系如图所示下列说法正确的是( )
的影响和平衡时溶液中相关离子浓度的关系如图所示下列说法正确的是( )
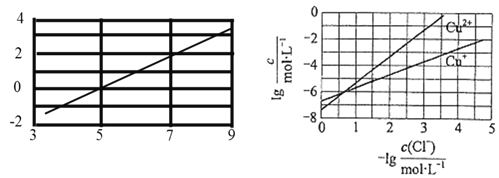
A.已知室温时AgCl的溶度积常数约为![]() ,则:
,则:![]()
B.向电解液中加入稀硫酸,有利于![]() 的除去
的除去
C.![]() 的平衡常数的数量级是
的平衡常数的数量级是![]()
D.除去上述电解循环溶液的产生![]() 的
的![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写化学方程式并注明反应类型(有机物写结构简式)
①实验室制取乙炔气体:________(________)
②甲苯制备TNT:________(________)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法净化水过程如图所示。下列说法中错误的是

A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的![]() 、
、![]() 、Cl通过阴离子树脂后被除去
、Cl通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH![]() H2O
H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com