
| A. | 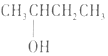 2--羟基丁烷 2--羟基丁烷 | B. | 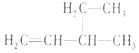 3--乙基--1--丁烯 3--乙基--1--丁烯 | ||
| C. | 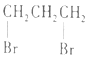 1,3--二溴丙烷 1,3--二溴丙烷 | D. | 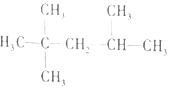 2,2,3--三甲基戊烷 2,2,3--三甲基戊烷 |
分析 A、-OH连在链烃基上的化合物为醇;
B、烯烃命名时,应选择含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子进行编号,并标出官能团的位置;
C、卤代烃命名时,应选择含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子进行编号,并标出官能团的位置;
D、烷烃命名时,选最长的碳链为主链,从离主链近的一端给主链上的碳原子进行编号,据此分析.
解答 解:A、-OH连在链烃基上的化合物为醇,选含-OH的最长的碳链为主链,故主链上有4个碳原子,故为丁醇,从离-OH近的一端给主链上的碳原子编号,故-OH在2号碳原子上,故为2-丁醇,故A错误;
B、烯烃命名时,应选择含官能团的最长的碳链为主链,故主链上有5个碳原子,故为戊烯;从离官能团近的一端给主链上的碳原子进行编号,故在1号和2号碳原子间有碳碳双键,在3号碳原子上有甲基,故名称为3-甲基-1-戊烯,故B错误;
C、卤代烃命名时,应选择含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子进行编号,故两个溴原子分别在1号和3号碳原子上,并标出官能团的位置,故名称为1,3-二溴丙烷,故C正确;
D、烷烃命名时,选最长的碳链为主链,故主链上有5个碳原子,故为戊烷;从离支链近的一端给主链上的碳原子进行编号,当两端离支链一样近时,要从支链多的一端给主链上的碳原子编号,故在2号碳原子上有2个甲基,在4号碳原子上有一个甲基,故名称为2,2,4-三甲基戊烷,故D错误;
故选C.
点评 本题考查了常见的有机物的命名,应注意掌握含官能团的有机物命名时,应以官能团为考虑对象.


科目:高中化学 来源: 题型:选择题
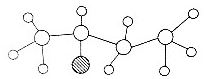
| A. | 该有机物肯定是的含烃氧衍生物 | |
| B. | 该有机物能发生取代反应和加成反应 | |
| C. | 该有机物可能是C4H9Cl | |
| D. | 该有机物可能与CH3CH2OCH2CH2互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,100 g 46%乙醇水溶液中含有H原子数为12Na | |
| B. | 23g Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为Na | |
| C. | 标准状况下,2.24 L CC14含有的共价鍵数为0.4Na | |
| D. | l molN2与4molH2反应生成的NH3分子数小于2Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
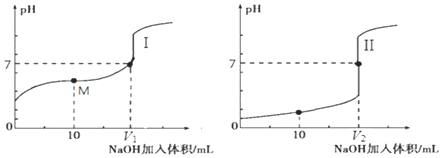
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
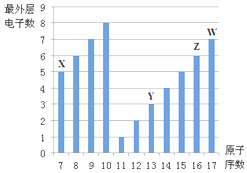 如图是部分短周期元素最外层电子数与原子序数的关系图.
如图是部分短周期元素最外层电子数与原子序数的关系图.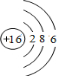 .
.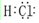 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能生成碱的金属元素都在ⅠA族 | |
| B. | 稀有气体元素原子的最外层电子数为2或8 | |
| C. | 原子序数为14的元素位于元素周期表的第3周ⅥA族 | |
| D. | 元素周期表有18个纵行,分列16个族,即7个主族、8个副族和1个0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NH3•H2O的pH小于13 | |
| B. | 0.1 mol•L-1 NH4Cl的pH小于7 | |
| C. | 相同条件下,浓度均为0.1 mol•L-1 NaOH溶液和氨水,氨水的导电能力弱 | |
| D. | 0.1 mol•L-1 NH3•H2O能使无色酚酞试液变红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com