
下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | ﹣2 | ﹣4 | ﹣2 | ﹣3 | ﹣1 | ﹣3 | ﹣4 | ﹣1 |
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 .
(2)A、B、C、E的简单氢化物稳定性顺序是 (用化学式回答).
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是 .
(4)请写出B的单质的一种重要用途: ;工业上制取该单质的原理反应为 .
| 位置结构性质的相互关系应用;元素周期律和元素周期表的综合应用.. | |
| 分析: | 短周期元素,A、C的最低化合价﹣2,处于第ⅥA族,A最高化合价+6,且A原子半径较大,故A为S元素,C为O元素;B、G都有最高正价+4、最低负价﹣4,处于ⅣA族,B的原子半径较大,则B为Si、G为碳元素;D、F都有最高正价+5、最低负价﹣3,处于ⅤA族,D的原子半径较大,则F为P元素、F为N元素;E、H都有最低化合价﹣1,处于ⅦA族,H有最高正化合价+7,且原子半径较大,则E为F元素、H为Cl元素,以此来解答. |
| 解答: | 解:短周期元素,A、C的最低化合价﹣2,处于第ⅥA族,A最高化合价+6,且A原子半径较大,故A为S元素,C为O元素;B、G都有最高正价+4、最低负价﹣4,处于ⅣA族,B的原子半径较大,则B为Si、G为碳元素;D、F都有最高正价+5、最低负价﹣3,处于ⅤA族,D的原子半径较大,则F为P元素、F为N元素;E、H都有最低化合价﹣1,处于ⅦA族,H有最高正化合价+7,且原子半径较大,则E为F元素、H为Cl元素, (1)G为碳元素,在周期中的位置是:第二周期ⅣA族;元素F所形成的常见单质为N2,其电子式为 故答案为:第二周期ⅣA族; (2)非金属性F>O>S>Si,则的氢化物稳定性顺序是HF>H2O>H2S>SiH4, 故答案为:HF>H2O>H2S>SiH4; (3)SOCl2在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸,则生成SO2与HCl,该反应的化学方程式是SOCl2+H2O=SO2↑+2HCl, 故答案为:SOCl2+H2O=SO2↑+2HCl; (4)硅单质可以用作半导体材料、制造合金、光电池等;工业上制取硅的反应为SiO2+2C 故答案为:用作半导体材料、制造合金、光电池等;SiO2+2C |
| 点评: | 本题考查性质结构位置关系应用,为高频考点,涉及电子式及化学方程式等常用化学用语、元素周期律等,题目难度中等,注意利用化合价与半径确定元素是解题关键. |


科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在pH=1的溶液中:K+、Na+、SO42–、HCO
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO、SO42–
C.在0.1 mol·L-1 FeCl3溶液中:K+、NH、I-、SCN-
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化铝钠(NaAlH4)是最有研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4 Na3AlH6+2Al+3H2↑.下列说法正确的是( )
Na3AlH6+2Al+3H2↑.下列说法正确的是( )
|
| A. | NaAlH4中氢元素为+1价 |
|
| B. | 每生成11.2 L(标准状况下)H2,转移2NA个电子 |
|
| C. | 在反应中有50%的氢被氧化 |
|
| D. | 反应中氧化产物与还原产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列热化学方程式
(1)C(s)+O2(g)═CO2 (g)△H1=﹣393.5kJ/mol
(2)H2(g)+O2(g)═H2O(l)△H2=﹣285.8kJ/mol
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
|
| A. | △H=﹣488.3 kJ/mol | B. | △H=+244.1 kJ/mol |
|
| C. | △H=﹣996.6 kJ/mol | D. | △H=+996.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列正确的叙述有( )
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2的反应、Ba(OH)2•8H2O与NH4Cl的反应均既为氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电镀、电化学腐蚀
⑥氯化铝溶液与氢氧化铝胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铝生成
⑦苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质
⑧金属元素和非金属元素形成的化合物一定是离子化合物.
|
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列曲线图(纵坐标为沉淀的量,横坐标为加入物的量)与对应选项不正确的是( )
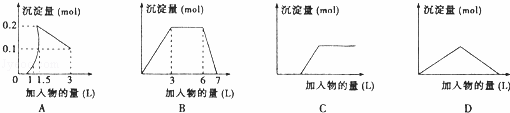
|
| A. | 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液中加入0.1 mol/L稀H2SO4溶液 |
|
| B. | 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的1L混合液中加入0.1mol/L NaOH溶液 |
|
| C. | 向烧碱溶液中滴加明矾溶液 |
|
| D. | 向Ca(OH)2溶液中逐渐通入二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.凡是盐,在离子方程式中都要以离子形式表示
B.离子互换反应总是向着溶液中反应物离子浓度减小的方向进行
C.酸碱中和反应的实质是H+与OH-结合生成水,故所有的酸碱中和反应的离子方程式都可写成H++OH-===H2O的形式
D.复分解反应必须同时具备离子反应发生的三个条件才能进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com