
500 mL 2 mol·L��1 FeCl3��Һ��500 mL 2 mol·L��1������Һ�ֱ�����ˮ�У������Ƴɷ�ɢϵ�ס��ң����ⶨ����ɢϵ�з�ɢ�ʵ�����ֱ����С��1��100 nm֮�䣬�ҷ�ɢϵ�з�ɢ�ʵ�����ֱ����С��10��9��10��7 m֮�䡣���й��ڼס��ҷ�ɢϵ���жϺ�������(����)
A���ڰ�������һ�������ġ�ǿ�⡱����ס��ң����ּ��ж����ЧӦ����û�ж����ЧӦ
B����ס����зֱ�μӹ���������������Һ�������ǡ��Ⱦ۳������ܽ⡱
C����ס����зֱ�μӹ���������ᣬ��������ֱ������ɫ��Һ����ɫ��Һ
D�����ɡ�����FeCl3��Һ��������Һ��õ���Ӧ�Ĺ�����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������������ȷ����(����)
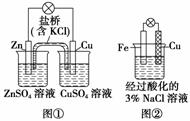
A��ͼ��������������ҺpH��С
B��ͼ���е�����Zn����Cu�������е�Cl������CuSO4��Һ
C��ͼ��������Ӧ��O2��2H2O��4e��===4OH��
D��ͼ���м�������K3[Fe(CN)6]��Һ������ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ȼ�ѧ����ʽ�С�H��ʾ��ȼ��ȼ���ȵ��ǣ� ��
A��C(s) + 1/2 O2(g) = CO(g) ��H= ��110.5 kJ/mol
B��2H2(g) + O2(g) = 2H2O(l) ��H= ��571.6kJ/mol
C��CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) ��H= ��802.3kJ/mol
D��CO(g) + 1/2 O2(g) = CO2(g) ��H= ��283.0kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й����ʷ���һ����ȷ����(����)
A��ǿ����ʣ����ᡢ��������������
B��������ʣ����ᡢ��������
C���ǵ���ʣ�Һ������������
D��ͬϵ�CH2O2��C2H4O2��C3H6O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й��������ʵ�Ӧ����ȷ����(����)
A��ʯӢ�������£������������ۻ�NaOH����
B��Ũ��������ˮ�ԣ������������
C������������Ư���ԣ��ɴ������ڼӹ�Ư��ʳƷ
D��ҽ�þƾ���ʹ�����ʱ��ԣ�����������ɱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)�����£����ܽ�Ũ����ʢ������Ͱ��(����)
(2014·���ȫ������6B)
(2)NH4Fˮ��Һ�к���HF�����NH4F��Һ���ܴ���ڲ����Լ�ƿ��(����)
(2014·������ۣ�3B)
(3)��ȼ����Ҫ�Ǽ�����ˮ�ڵ��¸�ѹ���γɵ�ˮ���ᄃ�壬��˿ɴ����ں���(����)
(2014·������ۣ�3C)
(4)����պŨ������ް��������Ͱ����Ĺܵ��Ƿ�©��(����)
(2013·�¿α�ȫ������7B)
(5)��SO2Ư��ֽ���Ͳ�ñ��(����)
(2013·�㶫���ۣ�11A)
(6)��������ϴ��¯�е�ˮ��(����)
(2013·�㶫���ۣ�11B)
(7)��Na2S������������ȥ��ˮ�е�Cu2����Hg2��(����)
(2013·�㶫���ۣ�11D)
(8)ʯӢֻ�������������ά(����)
(2013·�������ۣ�6A)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʰ��������������ʡ��ǵ���ʵ�˳����ϵ�һ��Ϊ(����)
A������ˮ����ˮ������������������
B�����ᡢ�����������ơ��ɱ�
C�����������ᡢ����̼���
D����ʯ�ҡ�Ư�ۡ��Ȼ�ͭ��̼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й���û�з�����ѧ��Ӧ����
A���û���̿ȥ�������е���ζ B�����ȼ�ˮ��������ϲ���������
C���ý��ݹ����������Һ��שͷ����ˮ��
 D���ú��轺�����۵���С����ʳƷһ���ܷ��װ
D���ú��轺�����۵���С����ʳƷһ���ܷ��װ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij����С����Ƶ�ʵ������ȡ����������װ������ͼ��ʾ��A�з���Ũ���ᣬB�з����Ҵ�����180������ˮ�����ƣ�D�з��к��з�̪����̼������Һ��
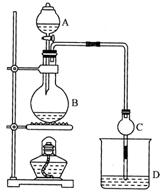 ��֪����ˮ�Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl2��6 C2H50H
��֪����ˮ�Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl2��6 C2H50H
���й��л���ķе�:
| �Լ� | ���� | �Ҵ� | ���� | �������� |
| �е�/�� | 34.7 | 78.5 | 118 | 77.1 |
��ش�
��1��Ũ����������� ������ͬλ��180ʾ�ٷ�ȷ����Ӧ����ˮ��������ԭ�ӵ��ṩ�ߣ�д���ܱ�ʾ180λ�õĻ�ѧ����ʽ��
��
��2�����θ����C�������� ����Ӧ������D�е������� ��
��3������ʵ���б���̼������Һ�������� ��
��4������D�еõ����������ķ��뷽���� ����D�з���������������г�����һ�������Ҵ������Ѻ�ˮ��Ӧ�ȼ�����ˮ�Ȼ��ƣ������ ��
��5��ij��ѧ����С���������ͼ��ʾ����ȡ����������װ��(ͼ�е�����̨�����С�����װ������ȥ)������ͼװ����ȣ���װ�õ���Ҫ�ŵ��У�(��д������)
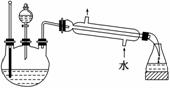
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com