
向甲、乙、丙三个密闭容器中充入一定量的X和Y,发生反应:x(g)+aY(g) 2Z(g)。各容器的反应温度、反应物起始量,反应过程中Z的浓度随时间变化关系分别以下图和下表表示。下列说法不正确的是
2Z(g)。各容器的反应温度、反应物起始量,反应过程中Z的浓度随时间变化关系分别以下图和下表表示。下列说法不正确的是
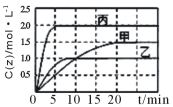
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.0molX 0.5molY | 1.0molX 0.5molY | 4.0molX 2.0molY |
A.该反应温度升高,平衡常数减小
B.20min内甲容器中反应的平均速率: v(X) = 0.075mol·(L·min)-1
C.其他条件不变,若缩小乙的体积,Y的转化率不变
D.10min时,其他条件不变,向乙容器中再加入2 molZ,平衡向逆反应方向移动
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
下表是安徽盐业总公司专营的海藻加碘盐包装袋上的部分文字说明:
配料 | 精制盐、碘酸钾(以I计,18—33mg/kg) |
食用方法 | 烹饪时加入,菜熟后最佳 |
保存方法 | 密封避光,常温防潮 |
根据包装袋上的文字说明某学生作出如下判断,其中不正确的是
A.此食盐是混合物
B.“烹饪时加入,菜熟后最佳”的原因可能是碘酸钾受热不稳定
C.碘酸钾(KIO3)中碘的化合价+5
D.1kg此食盐中含碘酸钾(18—33)mg
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色说明H2O2的氧化性比Fe3+强
B.含有铝元素的盐的水溶液一定显酸性
C.水玻璃可用做制备木材防火剂的原料
D.SO2和乙烯均能使溴水褪色,其原理相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
已知:CO(g)+H2O(g) CO2(g)+H2(g) H=– 41 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) H=– 41 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
n(CO) | n(H2O) | n(CO2) | n(H2) | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q1 |
③ | 1 | 1 | 2 | 1 | 热量变化:Q2 |
下列说法中,不正确的是
A.若容器①中反应10min达到平衡,0至10min时间内,用CO表示的平均反应速率υ(CO)=4.0×10-2 mol/(L·min)
B.容器③中,开始时υ(CO)生成>υ(CO)消耗
C.达平衡过程体系能量的变化:Q1=4Q2
D.平衡时,①与②容器中CO的体积分数相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:简答题
(16分) 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH=+8. 0 kJ·mol-1 2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH=+90. 4 kJ·mol-1 |
方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸
|
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:
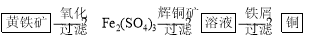
(1)Ⅱ相对于Ⅰ的优点是______________________________。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________(可以写表达式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:选择题
化学与科技、社会、生产、生活密切相关。下列有关说法正确的是
A.氟利昂和NOX都能破坏臭氧层,从而导致“温室效应”
B.针对H 7 N 9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、活性银离子、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学核心
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.肌红蛋白、蚕丝、过氧化氢酶、鱼油充分水解后不能全部都得到氨基酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三“二诊”考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.能使pH试纸呈红色的溶液中可能大量存在以下离子:Na+、NH4+、I一、NO3-
B.将CH3COOH溶液和NaOH溶液等体积混合,该溶液中一定存在的关系式为:c(Na+)=c(CH3COO一)+c(CH3COOH)
C.pH=3的NaHA溶液中粒子浓度大小为:c( Na+)>c( HA一)>c(A2一)>c(H2A)>c(OH一)
D.CuSO4溶液遇到闪锌矿(ZnS)慢慢转化为铜蓝(CuS),是因为ZnS的溶解度大于CuS
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
运用化学知识判断,下列说法正确的是
A.地沟油的主要成分是高级脂肪酸甘油酯,可食用
B.NOx、SO2、CO2、PM2.5颗粒都会导致酸雨
C.高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害
D.石油化工中的分馏、裂化、裂解都是通过化学反应来获得轻质油、气态烯烃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三下学期第一次模考理综化学试卷(解析版) 题型:填空题
【化学选修-化学与技术】(15分)铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作______________剂。
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式: 。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
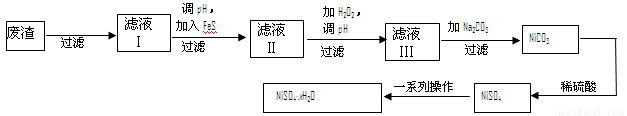
① 向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为 。
向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为 。
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是 ,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com