
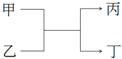
 甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )
甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )| A. | H2和Na | B. | S和O2 | C. | C和Si | D. | Cl2和Br2 |
分析 若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,该反应为置换反应,钠能和水或酸反应生成氢气、碳和二氧化硅反应生成Si单质,溴属于长周期元素,据此分析解答.
解答 解:若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,该反应为置换反应,钠能和水或酸反应生成氢气2Na+2HCl=2NaCl+H2↑、碳和二氧化硅反应生成Si单质2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,且Na和H、C和Si都属于同一主族短周期元素,甲为Na或C,丙为HCl或SiO2符合条件,A不符合,C符合,硫和氧是氧气可以置换硫、溴属于长周期元素,BD不符合条件,
故选C.
点评 本题以元素化合物知识为载体考查置换反应及元素周期表结构等知识点,明确物质的性质是解本题关键,注意C能置换出Si单质,但生成CO而不是二氧化碳,为易错点,题目难度中等.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳原子数小于或等于10的烷烃中其一氯代物只有一种的烷烃有4种 | |
| B. | C8H10中只有三种属于芳香烃的同分异构体 | |
| C. | 结构简式为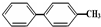 的烃,分子中含有两个苯环的该烃的同分异构体为4种 的烃,分子中含有两个苯环的该烃的同分异构体为4种 | |
| D. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分 组 实 验 | 催化剂 | |
| ① | 10mL 5%的H2O2溶液 | 无 |
| ② | 10mL 2%的H2O2溶液 | 无 |
| ③ | 10mL 5%的H2O2溶液 | 1mL 0.1mol/L的FeCl3溶液 |
| ④ | 10mL 5%的H2O2溶液+少量盐酸 | 1mL 0.1mol/L的FeCl3溶液 |
| ⑤ | 10mL 5%的H2O2溶液+少量NaOH溶液 | 1mL 0.1mol/L的FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),有关反应、数据和实验步骤如下:
),有关反应、数据和实验步骤如下:
| 熔点/℃ | 沸点/℃ | 颜色 | 水溶性 | 相对分子质量 | |
| 对氯甲苯 | 7.5 | 162 | 无色 | 难溶 | 126.5 |
| 对氯苯甲酸 | 243 | 275 | 白色 | 微溶 | 156.5 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
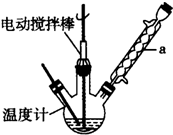 甲苯(
甲苯(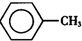 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(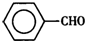 )、苯甲酸(
)、苯甲酸(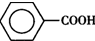 )等
)等| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
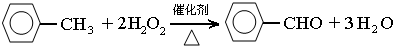 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水不导电,所以水不是电解质 | |
| B. | SO3水溶液的导电性很强,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃30mL 2mol/L的X溶液 | ||
| C. | 20℃10mL 4mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com