
下列叙述中不正确的是( )
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强
B.含极性键的分子一定是极性分子
C.判断A2B或AB2型分子为极性分子的依据:具有极性键且分子构型不对称、键角小于180°的非直线形结构
D.非极性分子中,各原子间不一定以非极性键结合
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)铝在自然界中有游离态和化合态两种形式( )
(2)Mg、Al在空气中性质稳定,因而都具有很强的抗腐蚀性( )
(3)MgO与Al粉的混合物也可称为铝热剂( )
(4)Mg是活泼金属,而Al是两性金属( )
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的Mg和Al的混合物投入250 mL 2.0 mol·L-1的稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示。则下列说法正确的是( )
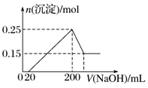
A.当加入氢氧化钠溶液的体积为20 mL时,溶液的pH等于7
B.当加入氢氧化钠溶液的体积为20 mL时,溶液中的溶质只有硫酸镁和硫酸铝
C.NaOH溶液的物质的量浓度为5 mol·L-1
D.生成的H2在标准状况下的体积为10.08 L
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列反应的离子方程式:
(1)在氯化锌溶液中加入过量的氨水________________________________。
(2)在硫酸铜溶液中加入过量的浓氨水______________________________。
(3)氯化银溶于浓氨水____________________________________________。
(4)在FeCl3溶液中加入过量的氨水________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在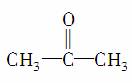 分子中,羰基碳原子与甲基碳原子成键时所采取的杂化方式分别为( )
分子中,羰基碳原子与甲基碳原子成键时所采取的杂化方式分别为( )
A.sp2杂化;sp2杂化 B.sp3杂化;sp3杂化
C.sp2杂化;sp3杂化 D.sp1杂化;sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.BF3是三角锥形分子
B.NH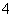 的电子式:
的电子式: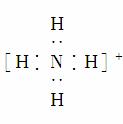 ,该离子呈平面正方形结构
,该离子呈平面正方形结构
C.CH4分子中的4个C—H键都是由氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D.CH4分子中,碳原子中的sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化过程中,原物质分子共价键被破坏,同时还有离子键形成的是( )
A.盐酸和NaOH溶液 B.氯化氢溶于水
C.溴化氢与氨反应 D.锌和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,平衡右移。你认为哪种说法正确?并说明原因。水的电离平衡移动后,溶液中c(H+)·c(OH-)是增大还是减小?
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,将体积为Va、pH=a的某一元酸与体积为Vb、pH=b的某一元碱混合,请完成下列各题。
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7。由此你能得到的结论是________________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00 mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11 mL。则b=________。
(3)若已知Va<Vb,a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com