
分析 (1)铁离子氧化性大于氢离子,金属没有剩余时,溶液中一定含有锌离子、铜离子、亚铁离子和氢离子,若铁离子足量,可能还含有铁离子;
(2)若有金属剩余,则由于还原性Zn>Cu,剩余的金属中一定含有Cu,若Zn足量,剩余金属中可能含有Zn、Fe;溶液中一定含有锌离子,若锌少量,可能含有亚铁离子、氢离子、铜离子;由于铁离子与铜反应,则一定不含铁离子.
解答 解:(1)向含有等物质的量的Fe3+、H+溶液中,加入Zn-Cu合金,Zn、Fe3+优先反应,若无金属剩余,说明Cu已经完全反应,则H+不反应,反应后溶液中一定含有Zn2+、Fe2+、Cu2+、H+,若Fe3+离子足量,则溶液中还含有Fe3+,
故答案为:Zn2+、Fe2+、Cu2+、H+;Fe3+;
(2)反应最终有金属剩余,根据还原性Zn>Cu可知,剩余的金属中一定含有Cu,若Zn足量,剩余金属中还可能含有Zn及被置换出的Fe;
由于金属Zn优先反应,剩余在溶液中一定含有Zn2+;若Zn少量,Cu部分参与反应,则溶液中可能含有Fe2+、Cu2+、H+,但是一定不含Fe3+,
故答案为:Cu;Zn、Fe;Zn2+;Fe2+、Cu2+、H+;Fe3+.
点评 本题考查了氧化还原反应及其应用,题目难度不大,明确发生反应的先后顺序为解答关键,注意掌握氧化还原反应实质与特征,试题培养了学生的分析能力及逻辑推理能力.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
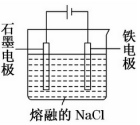
| A. | 通过该装置可以将化学能转化为电能 | |
| B. | 石墨电极为正极 | |
| C. | Na+在铁电极上得到电子被还原为钠 | |
| D. | 电流从负极流出,流入铁电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈酸性的雨水通常称为酸雨 | |
| B. | 翡翠、玛瑙、水晶等饰物都是硅酸盐制品 | |
| C. | 合金材料一定全部由金属元素组成 | |
| D. | 硅是制作太阳能电池的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发AlCl3溶液获得AlCl3固体 | |
| B. | 将Fe2(SO4)3溶液与NaOH溶液混合制备Fe(OH)3胶体 | |
| C. | 测定Na2CO3溶液、Na2SO3溶液的pH,比较C、S的非金属性强弱 | |
| D. | 以粗铜作阳极,纯铜片作阴极,CuCl2溶液作电解质溶液,电解精炼铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 用强碱溶液吸收工业制取硝酸的尾气:NO+NO2+2OH-=2NO${\;}_{3}^{-}$+H2O | |
| C. | 向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++HS-=CuS↓+H+ | |
| D. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com