
【题目】下表列出8种元素在元素周期表中的位置,结合所学内容回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出①的元素符号_________, 元素⑥的原子结构示意图____________________。
(2)写出元素⑤的最高价氧化物对应的水化物的电子式_____________, 该化合物中含有的化学键是_____________________。
(3)H元素分别与②、③、④形成的最稳定的气态氢化物是______________(写氢化物的化学式)。
(4)⑦、⑧是两种常见的非金属元素,从原子结构分析,原子半径⑦_______⑧(填写“>”或“<”);得电子能力较强是________ (填写元素符号);非金属性强弱关系是⑦_______⑧(填写“>”或“<”);⑧的单质通入⑦的钠盐溶液中,出现黄色沉淀,其离子方程式为_________________________________。
(5)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止;
③锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4。
该同学查找三种元素在周期表的位置如图所示:
Ⅳ | |
4 | Ge |
5 | Sn |
6 | Pb |
请解释产生上述性质变化的原因______________________________________。
【答案】 Li 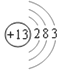
![]() 共价键 离子键 H2O > Cl < Cl2+S2-=2Cl-+S 锗、锡、铅随着原子序数的增多,原子半径逐渐增大,失电子能力逐渐增强,金属性逐渐增强
共价键 离子键 H2O > Cl < Cl2+S2-=2Cl-+S 锗、锡、铅随着原子序数的增多,原子半径逐渐增大,失电子能力逐渐增强,金属性逐渐增强
【解析】分析:首先根据8种元素在元素周期表的位置,判断出元素的名称,然后结合元素周期律、相关物质的性质、题干中的问题分析解答。
详解:根据8种元素在元素周期表的位置可知①~⑧分别是Li、C、N、O、Na、Al、S、Cl。则
(1)①是锂,元素符号为Li,元素⑥是Al,原子结构示意图为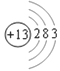 。
。
(2)元素⑤的最高价氧化物对应的水化物是氢氧化钠,含有离子键和共价键的离子化合物,电子式为![]() 。
。
(3)非金属性越强,氢化物越稳定,非金属性是C<N<O,则H元素分别与②、③、④形成的最稳定的气态氢化物是H2O。
(4)同周期自左向右原子半径逐渐减小,原子核对外层电子的吸引力逐渐增强,因此原子半径是S>Cl,得电子能力较强是Cl,非金属性强弱关系是S<Cl;⑧的单质通入⑦的钠盐溶液中,出现黄色沉淀,原因是氯气把硫离子氧化为单质硫,则其离子方程式为Cl2+S2-=2Cl-+S。
(5)根据题干信息可知锗、锡、铅的金属性逐渐增强,这是由于锗、锡、铅位于同一主族,随着原子序数的增多,原子半径逐渐增大,失电子能力逐渐增强,因此金属性逐渐增强。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某学习小组用下图装置研究Cl2的性质。
| 序号 | X | 实验现象 |
Ⅰ | AgNO3溶液 | 现象a | |
Ⅱ | 淀粉碘化钾溶液 | 溶液变蓝 | |
Ⅲ | 紫色石蕊溶液 | 溶液先变红后褪色 | |
Ⅳ | Na2SO3溶液 | 无明显现象 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断Cl2的化学性质是______。
(3)根据实验Ⅲ,结合化学方程式说明产生现象的原因:______。
(4)实验Ⅳ中无现象,如何证明反应发生了,简述实验方案______。
(5)结合离子方程式说明实验中NaOH溶液的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、乙二醇、丙三醇中分别加入足量的金属钠产生等体积的氢气(相同条件),则上述三种醇的物质的量之比是( )
A.2:3:6
B.6:3:2
C.4:3:1
D.3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)═CO2(g)△H1 C(s)+ ![]() O2(g)═CO(g)△H2 , 则△H2>△H1
O2(g)═CO(g)△H2 , 则△H2>△H1
C.已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( ) 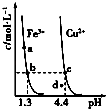
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C.加适量NH4Cl固体可使溶液由a点变到b点
D.c、d两点代表的溶液中c(H+)与c(OH﹣)乘积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是:
A. 标准状况下,VL气态烯烃(CnH2n)含中子的数目为![]()
B. 1LFe2(SO4)3溶液中,若c(Fe3+)=2 molL-1,则SO42-的数目为3NA
C. 一定量的硝酸和铁粉反应放出0.5mol气体,则转移的电子数一定是1.5NA
D. 46g甲酸含H-O键的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
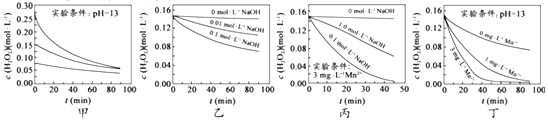
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液PH 越小,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项有机化合物的命名或分类正确的是( )
A.2,3﹣二甲基﹣2﹣乙基己烷
B.CH3CH2CH2Cl氯丙烷
C.![]() 属于芳香醇
属于芳香醇
D.![]() 属于芳香化合物
属于芳香化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
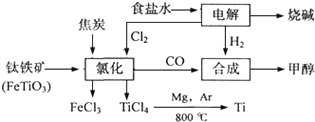
(1)写出钛铁矿经氯化法得到四氯化钛的化学方程式:_____________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=﹣641kJmol﹣1
②Ti(s)+2Cl2(g)=TiCl4(s);△H=﹣770kJmol﹣1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);△H=___________________________。反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
(3)在上述产业链中,合成192t甲醇理论上需额外补充H2___________t(不考虑生产过程中物质的任何损失).
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是_____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com