
科目:高中化学 来源:2015-2016学年宁夏高一下期末化学试卷(解析版) 题型:选择题
下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的铁粉加入稀硝酸中,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe2+ |
B | AlCl3溶液中滴加过量的氨水 | 先出现白色沉淀,后沉淀又逐渐溶解 | 氢氧化铝能溶于氨水 |
C | 铝箔插入稀硝酸中 | 无明显现象 | 铝箔表面被稀硝酸氧化形成致密的氧化膜 |
D | 用玻璃棒蘸取浓硫酸点到pH试纸上 | 试纸变黑色 | 浓硫酸具有脱水 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏高二下期末化学试卷(解析版) 题型:选择题
如图是一个核磁共振氢谱,请你观察图谱,分析其可能是下列物质中的 ( )

A. CH3CH2CH2CH3 B. (CH3)2CHCH3 C. CH3CH2CH2OH D. CH3CH2COOH
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下期末化学试卷(解析版) 题型:选择题
在实验室中,下列除去杂质的方法不正确的是
A. 溴苯中混有溴,将其加入NaOH稀溶液中反复洗涤、分液
B. 乙烷中混有乙烯,在一定条件下通入氢气,使乙烯转化为乙烷
C. 硝基苯中混有浓硝酸和浓硫酸,将其加入NaOH溶液中,静置、分液
D. 乙烯中混有CO2和SO2,将其通入NaOH溶液中洗气
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下期末化学试卷(解析版) 题型:选择题
在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A.H2S+2HNO3=S↓+2NO2↑十2H2O
B.CuO+2HNO3=Cu (NO3)2十H2O
C.4HNO3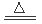 4NO2↑十O2↑十2H2O
4NO2↑十O2↑十2H2O
D.3Cu+8HNO3=3Cu (NO3)2+2NO↑十4H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下7.3周考化学试卷(解析版) 题型:实验题
单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃ ),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
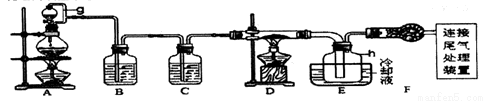
相关信息:① 四氯化硅遇水极易水解;② SIC14沸点为57.7℃ ,熔点为-70.0℃ 。请回答:
(1)写出装置A 中发生反应的离子方程式_______________。
(2)装置C 中的试剂是___________;装置F的作用是_______________;
装置E 中的h 瓶需要冷却的理由是_______________。
(3)装置E 中h 瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
① 反应的离子方程式:_______________。② 滴定前是否要滴加指示剂?_______________。(填“是”或“否”) ,请说明理由_______________。
③ 滴定前检验Fe3+ 是否完全还原的实验操作是_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:填空题
某市对大气进行检测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃烧、机动车尾气等。因此,对PM2.5、SO2、NO等进行研究具有重要意义。回答下列问题:
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H=-890.3KJ/mol
②N2(g)+O2(g)=2NO(g) ∆H=+180KJ/mol
CH4可用于燃烧脱硝,CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ∆H=_______________。
(2)汽车尾气中NOx和CO的生成及转化
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) ∆H>0。汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是_______________________。
2NO(g) ∆H>0。汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是_______________________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知反应的∆H>0,简述该设想能否实现的依据_______________________。
③目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其化学方程式为_______________。
(3)一定温度下,在密闭容器中反应2NO2(g)  N2O4(g) ∆H=-57.20KJ/mol达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____________(填字母)
N2O4(g) ∆H=-57.20KJ/mol达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____________(填字母)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
在一定温度和压强下,密闭容器中N2O4和NO2的混合气体达到平衡时,c(N2O4)=0.0120mol/L(已知2NO2(g)  N2O4(g)反应在该温度下的平衡常数K=40/3)。计算平衡时 NO2物质的量浓度为________________。
N2O4(g)反应在该温度下的平衡常数K=40/3)。计算平衡时 NO2物质的量浓度为________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
短周期元素X和Y,可组成化合物XY3,当X的原子序数为m,Y的原子序数可能是
①m+4 ②m﹣4 ③m﹣8 ④m+2 ⑤m﹣6 ⑥m+12.
A. ①②③ B. ①④⑤⑥ C. ①②③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com