
| A. | 单位时间内消耗2n molSO2的同时生成2n molS03,说明该反应达到平衡状态 | |
| B. | 达到化学平衡时,SO2、02和SO3的物质的量浓度均保持不变 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,SO2将完全转化为SO3 |
分析 A、任何时候都消耗2n molSO2的同时生成2n molS03;
B、根据化学平衡状态的特征:逆、定、动、变、等来回答;
C、化学平衡是一个动态平衡;
D、可逆反应不能完全反应到底.
解答 解:A、化学平衡是一个动态平衡,达到化学平衡时,正反应和逆反应的速率都不等于零,故A错误;
B、根据化学平衡状态的特征:各组分的浓度不随时间的变化而变化,即达到化学平衡时,SO2、02和SO3的物质的量浓度均保持不变,故B正确;
C、化学平衡是一个动态平衡,达到化学平衡时,正反应和逆反应的速率都不等于零,故C错误;
D、可逆反应不能完全反应到底,所以SO2不可能完全转化为SO3,故D错误.
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大,注意把握判断的角度以及平衡状态的特征,易错点为D,注意体会.


科目:高中化学 来源: 题型:解答题
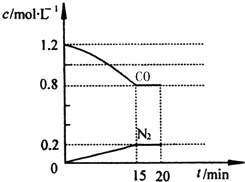
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红褐色溶液物质是Fe(OH)3胶体,气泡的成分是H2 | |
| B. | 红褐色沉淀是Fe(OH)3沉淀,黑色的物质是Fe | |
| C. | 除去红褐色溶液中少量沉淀的实验方法是参析 | |
| D. | 由于Fe3+在溶液中被水分子包围形成[Fe(H2O)4]3+,不利于铝粉与Fe3+的接触反应,所以只生成少量的单质铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Cl-、Ca2+ | B. | Mg2+、SO42-、OH- | C. | Na+、SO32-、H+ | D. | H+、K+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素的最高正价从左向右依次从+1递增到+7价 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在金属与非金属分界线附近寻找半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60是英国和美国化学家共同发现的,体现了国际科技合作的重要性 | |
| B. | 门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新 | |
| C. | 科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的学科 | |
| D. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题: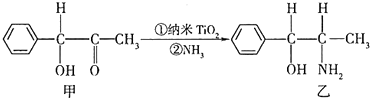
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com