
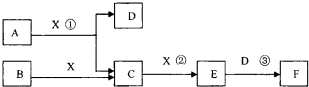
由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示(某产物已略去):

已知:B、X为单质,常温下D为无色液体,A、B含同一种元素。
请回答下列问题:
(1)若E气体是大气污染物,F是一元强酸。
①写出E→F反应的化学方程式: 。
②现有25℃时0.1 mol·L-1 A的水溶液,若向其中加入等体积0.1 mol·L-1的稀硫酸,则所得溶液中各离子的物质的量浓度由大到小的顺序是 。
③在常温下,向V1 L pH=a的A的水溶液中加入V2 L pH=b的盐酸,且a+b=14,若恰好完全反应,则V1和V2的关系为Vl V2(填“>”、“<”、“=”或“无法确定”),等pH的所得溶液与盐酸比较,由水电离出的c(H+)前者为后者的108倍,则两种溶液的pH= 。
(2)若E气体不是大气污染物,F是二元弱酸。
①B所含元素在周期表中的位置 。
②写出氧化铁与C反应的化学方程式: ;将少量气体E通入氢氧化钙溶液中得不溶物F,F的Ksp=2.8×10-9。现将该沉淀放入0.1 mol·L-1的CaCl2溶液中,其Ksp (填“增大”、“减小”或“不变”),此时,组成不溶物F的阴离子在溶液中的浓度为 。
(1)① 3NO2+H2O=2HNO3+NO ② c(H+)> c( SO42-) > c(NH4+) >c(OH-) ③ < 3
(2)①第二周期ⅣA族 ② Fe2O3+3CO 2 Fe +3CO2 不变 2.8×10-8 mol·L-1
2 Fe +3CO2 不变 2.8×10-8 mol·L-1
【解析】
试题分析:(1)根据物质间的相互转化关系及已知条件可推知A是NH3,B是N2,C是NO,D是H2O,E是NO2。F是HNO3,X是O2。①写出E→F反应的化学方程式是3NO2+H2O=2HNO3+NO;②氨水与硫酸等体积等浓度混合得到的为NH4HSO4溶液。NH4HSO4= NH4++H++SO42-。由于发生:NH4++H2O  NH3·H2O+H+。H2O
NH3·H2O+H+。H2O OH-+H+。所以所得溶液中各离子的物质的量浓度由大到小的顺序是c(H+)> c( SO42-) > c(NH4+)
>c(OH-)。③在常温下,对于NH3·H2O
pH=a,C(H+)= 10-amol/L ,C(OH-)=
10(a-14)mol/L pH=b的盐酸,C(H+)=10-bmol/L 且a+b=14,所以C(H+)= C(OH-)。由于碱为弱碱C(NH3·H2O)>C(HCl).若恰好完全反应, V1和V2的关系是V1<V2。若NH4Cl与HCl的PH相等,假设它们的PH为X,则前者水电离产生的C(H+)=10-amol/L,后者由水电离出的c(H+)为10-(a+8)mol/L, C(OH-)= c(H+)=10-(a+8)mol/L,在整个溶液中C(OH-)·c(H+)=Kw=10-14. 10-(a+8) ·10-a=10-14.解得a=3. 则两种溶液的pH=3.(2) 根据物质间的相互转化关系及已知条件可推知A是CH4,B是C,C是CO,D是H2O,E是CO2。F是H2CO3,X是O2。①B所含元素在周期表中的位置第二周期ⅣA族,②写出氧化铁与CO反应的化学方程式:Fe2O3+3CO
OH-+H+。所以所得溶液中各离子的物质的量浓度由大到小的顺序是c(H+)> c( SO42-) > c(NH4+)
>c(OH-)。③在常温下,对于NH3·H2O
pH=a,C(H+)= 10-amol/L ,C(OH-)=
10(a-14)mol/L pH=b的盐酸,C(H+)=10-bmol/L 且a+b=14,所以C(H+)= C(OH-)。由于碱为弱碱C(NH3·H2O)>C(HCl).若恰好完全反应, V1和V2的关系是V1<V2。若NH4Cl与HCl的PH相等,假设它们的PH为X,则前者水电离产生的C(H+)=10-amol/L,后者由水电离出的c(H+)为10-(a+8)mol/L, C(OH-)= c(H+)=10-(a+8)mol/L,在整个溶液中C(OH-)·c(H+)=Kw=10-14. 10-(a+8) ·10-a=10-14.解得a=3. 则两种溶液的pH=3.(2) 根据物质间的相互转化关系及已知条件可推知A是CH4,B是C,C是CO,D是H2O,E是CO2。F是H2CO3,X是O2。①B所含元素在周期表中的位置第二周期ⅣA族,②写出氧化铁与CO反应的化学方程式:Fe2O3+3CO 2 Fe +3CO2。因为沉淀的溶度积常数KSp只与温度有关,与离子的浓度大小无关,所以将该沉淀放入0.1 mol·L-1的CaCl2溶液中,其Ksp不变。此时,组成不溶物F的阴离子在溶液中的浓度为2.8×10-9÷0.1=2.8×10-8
mol/L.
2 Fe +3CO2。因为沉淀的溶度积常数KSp只与温度有关,与离子的浓度大小无关,所以将该沉淀放入0.1 mol·L-1的CaCl2溶液中,其Ksp不变。此时,组成不溶物F的阴离子在溶液中的浓度为2.8×10-9÷0.1=2.8×10-8
mol/L.
考点:考查元素、化合物的推断、离子浓度的比较、影响溶度积常数的因素及离子浓度的计算等知识。


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源:2012届山西省山大附中高三第一次模拟试题理综化学试卷(带解析) 题型:填空题
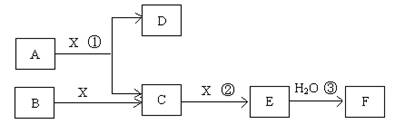
(14分)已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
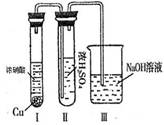
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是 。
③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方式 。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物G,G的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP ,(填:增大、减小或不变),此时,组成不溶物G的阴离子在溶液中的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三第一次模拟试题理综化学试卷(解析版) 题型:推断题
(14分)已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是 。
③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方式 。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物G,G的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP ,(填:增大、减小或不变),此时,组成不溶物G的阴离子在溶液中的浓度为 mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com