
二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料。从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:


(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为
。
(2)取少量浸取液,滴加KSCN溶液后呈血红色,说明溶液中存在 离子(填写离子符号),检验溶液中还存在Fe2+的方法是 (写明步骤、试剂和现象)。
(3)浸取液与铁屑反应的离子方程式为 ;X(晶体)的化学式为 。
(4)第③步反应化学方程式 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:

 已知:①Ksp[Mg(OH)2]=6.0×10—12
已知:①Ksp[Mg(OH)2]=6.0×10—12
②Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7.
③三种化合物的溶解度(S)随温度变化的曲线如右图所示。
(1)在盐泥中加入稀硫酸调pH为1~2以及第一次煮沸的目的是 。
(2)若溶液中Mg2+浓度为6.0mol•L-1,则溶液pH≥ 8
才能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO4•2H2O溶解度小等合理答案均可),所得滤渣的主要成分是 。
(4)从滤液Ⅱ中获得MgSO4•7H2O晶体的实验步骤依次为:
①向滤液Ⅱ中加入 NaOH溶液
; ②过滤,得沉淀并洗涤;
③ 向沉淀中加足量稀硫酸
;
④蒸发浓缩,降温结晶; ⑤过滤、洗涤得产品。
(5)若获得的MgSO4•7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为 20.0%
(MgSO4•7H2O的相对分子质量为246)。
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾[KAl(SO4)2•12H2O]相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500ml稀氨水(每升含有39.00g氨)需要取浓氨水(每升含有250g氨)__________ml,用规格为_______ml量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。
检验NH4+的方法是_______________________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________。
(4)滤液的成分是水和______________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。②_______、______、干燥(填实验操作名称)。③冷却、称重。ks5u
(6)若试样为mg,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为:______(用含有m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的应用正确的是
A.有机磷农药多为磷酸酯或硫代磷酸酯类物质,肥皂水等碱性物质有利其水解而解毒
B.二氧化硅是制造太阳能电池板的主要材料
C.二氧化硫通入酸性KMnO4溶液,溶液紫红色褪去,体现了SO2的漂白性
D.常温下浓H2SO4和浓HNO3都能使Cu发生钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
H7N9型禽流感是全球首次发现的新亚型流感病毒,达菲(Tamiflu)是治疗该病毒的最佳药物。以莽草酸为原料,经多步反应可制得达菲和对羟基苯甲酸。达菲、莽草酸、对羟基苯甲酸的结构简式如下:

达菲 莽草酸 对羟基苯甲酸
下列有关说法正确的是
A.达菲、莽草酸、对羟基苯甲酸都属于芳香族化合物
B.1mol莽草酸与NaOH溶液反应,最多消耗4molNaOH
C.对羟基苯甲酸较稳定,在空气中不易被氧化
D.利用FeCl3溶液可区别莽草酸和对羟基苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
自然界中存在大量的金属元素,其中钠、镁、铁、铜等在工农业生产中有着广泛的应用。
(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂。请写出Fe元素的基态原子核外电子排布式 。
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac— = CH3COO—),其反应是:
[Cu(NH3)2] Ac +CO+NH3  [Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)] △H<0
[Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)] △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为 。
②[Cu(NH3)2]+中存在的化学键类型有 (填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
③氨分子中N原子的杂化方式为 。
 (3)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃, MgO的熔
(3)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃, MgO的熔
点高达2800℃。造成两种晶体熔点差距的主要原因是 。
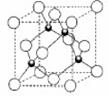
(4)铜的化合物种类也很多,其常见价态为+1、+2价。如CuO、Cu2O、
CuH等。右图是铜的一种氯化物晶体的晶胞结构,则它的化学式是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
由下列实验事实得出结论错误的是
A.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性
B.浓硫酸可用作气体干燥剂,说明浓硫酸具有吸水性
C.铜与浓硫酸共热有刺激性气味气体放出,说明浓硫酸具有强氧化性
D. SO2能使紫红色的酸性高锰酸钾溶液褪色,说明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋是个巨大的资源宝库,利用海水可制取许多化工产品。
(1)氯碱工业是以电解食盐水为基础化学工业,写出电解食盐水的化学方程式_________
__________________________________________________________.
(2)从海水中提取溴常用吹出法,即用氯气(Cl2)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2)。流程示意图如下:

①写出氯气从NaBr中置换出溴单质的化学方程式:____________________;该反应在pH=3的酸性条件下进行,可用________测定反应液的酸碱度。
②吹出的溴和大量空气混合在—起进入吸收塔,根据流程图分析,通入SO2和水的目的是。_____________________________________________________.(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
有50ml0.1mol/L碘水,当通入足量Cl2完全反应后,共转移了0.05mol电子,则下列叙述错误的是
A.该反应中H2O是反应物之一 B.氧化剂与还原剂的物质的量之比为1∶5
C.氧化产物为HIO3 D.若有1 mol I2参加氧化反应,转移10 mol e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com