
 X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:| 1 |
| 2 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
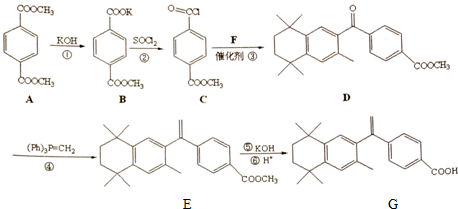
 ,则不含苯环的有机产物的结构简式为
,则不含苯环的有机产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种金属常温下均不溶于足量的浓硝酸中 |
| B、三种金属久置于潮湿的空气中均能生成氧化物而生锈 |
| C、三种金属均能与硫反应,分别生成Cu2S、Al2S3、FeS |
| D、三种金属的还原性:Al>Fe>Cu;离子的氧化性:Cu2+>Fe3+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
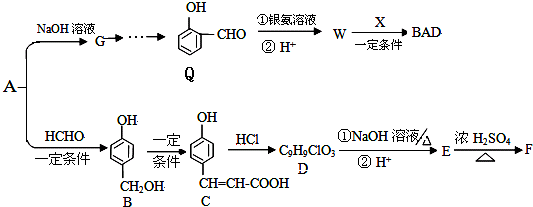
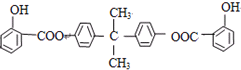
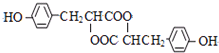
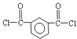 )发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式
)发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式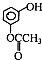
查看答案和解析>>
科目:高中化学 来源: 题型:
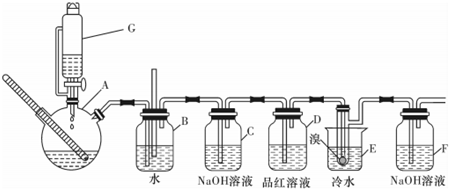
| 乙醇 | 1.2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/(g/cm) | 0.79 | 2.2 | 0.71 |
| 沸点/ | 78.5 | 132 | 34.6 |
| 熔点/ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
| B. | NaCl(s) | KNO3(s) | AgNO3溶液 | 过滤 |
| C. | 苯 | 苯酚 | 浓溴水 | 过滤 |
| D. | 苯 | 甲苯 | KMnO4(酸化),NaOH溶液 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 丁 |
| 丁 |
| 甲 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com