
| A. | 稀硝酸中加入过量铁粉:Fe+4H++NO${\;}_{3}^{-}$═Fe3++NO↑+2H2O | |
| B. | 向NH4HSO4溶液中逐滴滴入Ba(OH)2溶液至恰好沉淀完全2OH-+Ba2++2H++SO${\;}_{4}^{2-}$═2H2O+BaSO4↓ | |
| C. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO${\;}_{3}^{-}$═3BaSO4↓+2NO↑+H2O | |
| D. | 向Ca(ClO)2溶液中通入足量CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
分析 A.铁粉过量反应生成二价铁子;
B.二者等物质的量反应时恰好沉淀完全;
C.硝酸具有强的氧化性,能够氧化亚硫酸根离子生成硫酸根离子;
D.二氧化碳过量,反应生成次氯酸和碳酸氢钙;
解答 解:A.稀硝酸中加入过量铁粉,离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故A错误;
B.向NH4HSO4溶液中逐滴滴入Ba(OH)2溶液至恰好沉淀完全,离子方程式:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O,故B错误;
C.向亚硫酸钡固体中加入稀硝酸,离子方程式:3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O,故C正确;
D.向漂白粉溶液中通入过量的CO2,离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,侧重考查氧化还原型离子反应,明确物质的性质及发生反应实质是解题关键,注意反应物用量对反应的影响,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 高铁酸盐(含FeO42-离子)是新型、高效、多功能水处理剂,既能消毒杀菌又能净水 | |
| B. | 用硫酸清洗锅炉中的水垢 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 使用Na2S作沉淀剂,可有效除去废水中Cu2+和Hg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
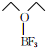 )的熔点为-58℃,沸点为126~129℃,它属于分子晶体.
)的熔点为-58℃,沸点为126~129℃,它属于分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用漏斗过滤,去除盐水中的CaCO3 | B. | 用饱和食盐水洗去Cl2中少量的HCl | ||
| C. | 用CCl4萃取碘水中的碘 | D. | 用升华法除去NaCl中混有的少量碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
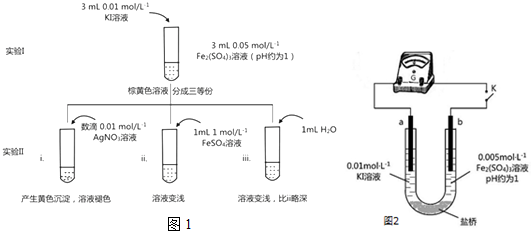
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
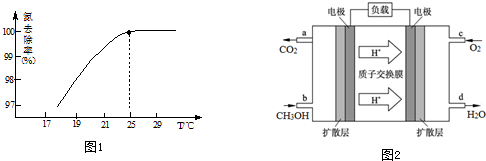
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取氯乙烷(CH3一CH2Cl)的最好的方法是乙烷与氯气发生取代反应 | |
| B. | 乙烯、苯都能使溴水褪色,两者的褪色原理相同 | |
| C. | 2-丁烯不存在顺反异构体 | |
| D. | 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是法国化学家李比希 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应既属于氧化还原反应,又属于离子反应 | |
| B. | 生成1 mol Cl2转移电子数均为2NA | |
| C. | 盐酸浓度越大,Cl-的还原性越强 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com