
| 装置 | 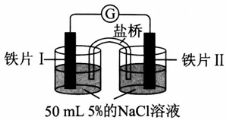 | 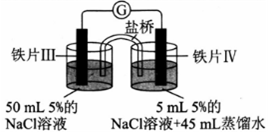 |
| 现象 | 电流计指针未发生偏转 | 电流计指针偏转 |
| A. | 加热铁片I所在烧杯,电流表指针会发生偏转 | |
| B. | 用KSCN溶液检验铁片Ⅲ、IV附近溶液,可判断电池的正、负极 | |
| C. | 铁片I、Ⅲ的腐蚀速率相等 | |
| D. | “电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀 |
分析 A.加热铁片I失电子的速率加快,会有电子通过电流表;
B.Fe在负极失电子生成亚铁离子;
C.形成原电池会加快反应速率;
D.铁片I、铁片Ⅱ都发生了腐蚀,但是腐蚀的速率相同.
解答 解:A.Fe在氯化钠溶液中发生吸氧腐蚀,加热铁片I失电子的速率加快,会有电子通过电流表,电流表指针会发生偏转,故A正确;
B.Fe发生电化学腐蚀时,Fe在负极失电子生成亚铁离子,加KSCN溶液无现象,无法检验,是否有亚铁离子生成,则不能判断正负极,故B错误;
C.形成原电池会加快反应速率,铁片Ⅲ的腐蚀速率比铁片I快,故C错误;
D.Fe在氯化钠溶液中发生吸氧腐蚀,所以铁片I、铁片Ⅱ都发生了腐蚀,由于电解质溶液的浓度相同,所以铁片I、II腐蚀的速率相同,故D错误.
故选A.
点评 本题考查了原电池原理的应用,题目难度中等,注意把握原电池的原理、金属的电化学腐蚀、影响反应速率的因素,侧重于考查学生的分析能力和对基本原理的应用能力.


科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 二 | C | N | ① | |||||
| 三 | ② | ③ | ④ | P | ⑤ | ⑥ |
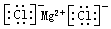 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),同时利用此装置的电能在铁上镀铜,下列说法错误的是( )
),同时利用此装置的电能在铁上镀铜,下列说法错误的是( )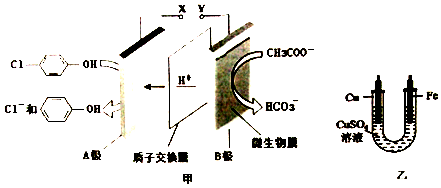
| A. | 铁电极应与Y相连接 | |
| B. | 反应过程中甲中右边区域溶液pH逐渐升高 | |
| C. | A极的电极反应式为 +2e-+H+=Cl-+ +2e-+H+=Cl-+ | |
| D. | 当外电路中有0.2 mole-转移时,A极区增加的H+的个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,44.8L NO与22.4L O2反应后的分子数是2NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与6.5g锌共热,转移的电子数等于0.2NA | |
| C. | 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA | |
| D. | 0.5mol苯乙烯( 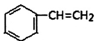 )中含有碳碳双键的数目为2NA )中含有碳碳双键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和水 | B. | 硝酸钾和氯化钠 | ||
| C. | 食盐水和泥沙 | D. | 乙酸丁酯和1-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
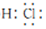 .常温下Na2SiO3溶液的pH>(填“>”“<”或“=”) 7. ②用化学方程式表示该制备原理:2HCl+Na2SiO3+(n-1)H2O=SiO2•nH2O↓+2NaCl.
.常温下Na2SiO3溶液的pH>(填“>”“<”或“=”) 7. ②用化学方程式表示该制备原理:2HCl+Na2SiO3+(n-1)H2O=SiO2•nH2O↓+2NaCl.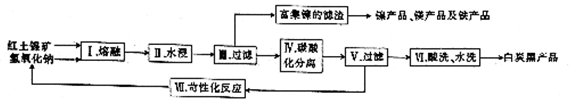
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
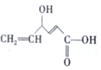 ,下列关于X的说法正确的是( )
,下列关于X的说法正确的是( )| A. | X中有4种官能团 | |
| B. | X的分子式为C6H5O3 | |
| C. | X可发生氧化、取代、加成反应 | |
| D. | 1molX与足量钠反应可生成11.2L气体(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Br>Ga>Cl>Al | |
| B. | 碱性:Ga(OH)3>Al(OH)3 酸性:HClO4>HBrO4 | |
| C. | 7935Br与8135Br得电子能力不同 | |
| D. | 与镓同周期且相邻的主族元素,其原子序数为30或32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com