
工业上电解熔融NaCl与电解食盐水都能直接得到的物质是()
A. Na B. Cl2 C. H2 D. NaOH
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)⇌N2(g)+2CO2(g),下列说法不正确的是()
A. 升高温度可使该反应的逆反应速率降低
B. 使用高效催化剂可有效提高正反应速率
C. 反应达到平衡后,NO的反应速率保持恒定
D. 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
有Xn+、Ym+、Zn﹣,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数.若按X→Y→Z的顺序,下列说法中正确的是( )
A. 它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强
B. 它们的原子半径依次增大
C. 它们的单质在常温.常压下的密度依次减小
D. 它们的最高价氧化物的水化物都是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
我国发射的“神舟五号”载人飞船的燃料是铝粉与高氯酸铵的混合物.点燃时,铝粉氧化放热引发高氯酸铵反应2NH4ClO4=N2↑+4H2O+Cl2↑+O2↑;△H<0.关于该反应叙述不正确的是()
A. 该反应属于分解反应、氧化还原反应、放热反应
B. 该反应瞬间能产生大量高温气体,推动飞船飞行
C. 从能量变化上看,该反应是化学能转变为热能和动能
D. 反应中NH4ClO4只起到氧化剂的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4 Ti已知:①C(s)+O2(g)=CO2(g);△H=﹣393.5kJ•mol﹣1②2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ•mol﹣1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ•mol﹣1,则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ/mol.
Ti已知:①C(s)+O2(g)=CO2(g);△H=﹣393.5kJ•mol﹣1②2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ•mol﹣1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ•mol﹣1,则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是一个电解装置图,某实验兴趣小组做完实验后,在读书卡片上写下了一些记录:()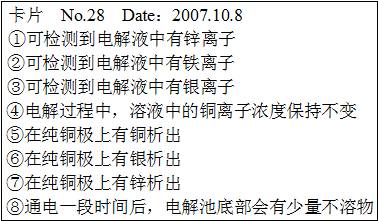 卡片上描述合理的是(已知粗铜中除含有铜以外,还含有少量锌、铁、银)
卡片上描述合理的是(已知粗铜中除含有铜以外,还含有少量锌、铁、银)
A. ①②⑤⑧ B. ①⑤⑧ C. ①②④⑤⑧ D. ③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
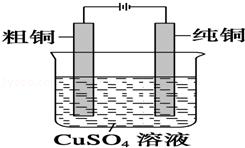
用含有少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极减少的Cu的质量为m g,则()
A. 电解液质量增加m g B. 阴极质量增加a g,a>m
C. 阴极质量增加m g D. 阴极质量增加b g,b<m
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录。
| 步 骤 | 现 象 |
| I. 取5 mL 0.1 mol/L AgNO3与一定体积0.1 mol/L NaCl溶液,混合,振荡。 | 立即产生白色沉淀 |
| II. 向所得悬浊液中加入2.5 mL 0.1 mol/L Na2S溶液。 | 沉淀迅速变为黑色 |
| III. 将上述黑色浊液,放置在空气中,不断搅拌。 | 较长时间后,沉淀变为乳白色 |
| IV. 滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液。 | 产生红棕色气体,沉淀部分溶解 |
| V. 过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液。 | 产生白色沉淀 |
(1) 为了证明沉淀变黑是AgCl转化为Ag2S的缘故,步骤I中NaCl溶液的体积范围为 。
(2) 已知:25℃时Ksp(AgCl)=1.8×10-10 ,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K= 。
(3)步骤V中产生的白色沉淀的化学式为 ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 。
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
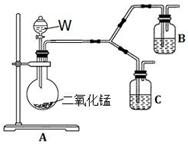
①装置A中玻璃仪器有圆底烧瓶、导管和 ,试剂W为 。
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为 。
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:
□Ag2S + □NaCl + □ + □  □AgCl + □ S + □
□AgCl + □ S + □
B中NaCl的作用是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com