
【题目】第四周期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。写出Cr在周期表中的位置___;其原子核外电子排布的最高能层符号为___。
(2)在1molCrO5(其中Cr为+6价)中,含有过氧键的数目为__。
(3)钒(23V)广泛用于催化及钢铁工业,被称之为“工业的味精”。写出钒原子价电子排布图___;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___。
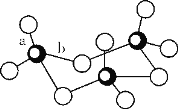
(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是____。(填元素符号)
(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。CaTiO3晶胞如图,边长为a=0.266nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___nm,与Ti紧邻的O个数为___。
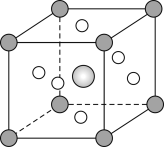
(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于___位置,O处于___位置。
【答案】第四周期第VIB族 N 2×6.02×1023(或2NA) ![]() sp3 C 0.188 12 体心 棱心
sp3 C 0.188 12 体心 棱心
【解析】
根据化合价之和为0 ,计算过氧键的数目;钒原子价电子排布式为3d34s2,结合泡利原理、洪特规则画出价电子排布图; S原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断S原子杂化类型;C原子与O原子均含有1对孤对电子,电负性越强越不易提供孤对电子;Ti与O之间的最短距离为晶胞面对角线长度的一半。
(1)Cr为24号元素,在元素周期表中的位置为第四周期第ⅥB族,核外电子排布最高的能级层为第4层,为N层;
(2)过氧根中的氧的化合价为-1价,其他的氧为-2价,则可以设有x个过氧根,有y个氧离子,则根据化合物的化合价代数和为0以及原子守恒,过氧根中有2个O为-1价,则有2x×(-1)+ y×(-2)+5=0,2x+y=5,可以求得x=2,则1molCrO5中含有2mol过氧键,过氧键的数目为2×6.02×1023(或2NA);
(3)V为23号元素,其价电子的排布为3d34s2,则其价电子排布图为![]() ;从示意图可以看出来,每个S原子与4个氧原子形成四面体结构,类似于CH4,故其S原子的杂化类型为sp3;
;从示意图可以看出来,每个S原子与4个氧原子形成四面体结构,类似于CH4,故其S原子的杂化类型为sp3;
(4) Ni(CO)4中,配位原子能够提供电子对,其配位原子是否有孤对电子和电负性有关,O的电负性太大,不易提供电子对,而O的孤对电子配位给C原子,使得C原子一端拥有的电子较多,而且C的电负性没有O大,易给出电子,因此配位原子是C;
(5)晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为面对角线的一半,为![]() ,与Ti紧邻的O,在Ti原子的上部有4个,在与Ti原子同平面的有4个O原子,在Ti原子的下面也有4个O原子,一共12个;
,与Ti紧邻的O,在Ti原子的上部有4个,在与Ti原子同平面的有4个O原子,在Ti原子的下面也有4个O原子,一共12个;
(6) CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,O与Ca在同一直线上,则O在棱上;Ti在Ca形成的六面体的中心,则Ti为体心,所以Ti处于体心,O处于棱心位置。


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A. 0.10mol/LAg+B. 0.20mol/LZn2+C. 0.20mol/LCu2+D. 0.20mol/LPb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z。反应2 min后,测得参加反应的X2为0.6 mol·L-1,用Y2的变化表示的反应速率v(Y2)=0.1 mol·L-1· min-1,生成的c(Z)为0.4 mol·L-1,则该反应的化学方程式是( )
A.X2+2Y2![]() 2XY2B.3X2+Y2
2XY2B.3X2+Y2![]() 2X3Y
2X3Y
C.X2+3Y2![]() 2XY3D.2X2+Y2
2XY3D.2X2+Y2![]() 2X2Y
2X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是我国学者研发的高效过氧化氢一尿素电池的原理装置:
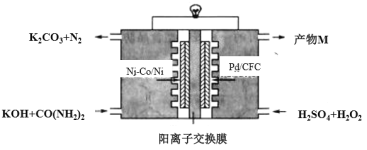
该装置工作时,下列说法错误的是
A.Ni-Co/Ni极上的电势比Pd/CFC极上的低
B.向正极迁移的主要是K+,产物M主要为K2SO4
C.负极反应为:CO(NH2)2+8OH–-6e–=CO32–+N2↑+6H2O
D.Pd/CFC极上发生反应:H2O2+2e–=2OH–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+![]() O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+![]() O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___;该反应的平衡常数Kp=___Pa。若提高C3H8的平衡转化率,可采取的措施有___(填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
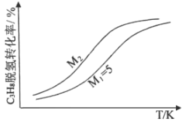
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___5(填“>”或“<”)。
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___。反应气中![]() 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时![]() 的配比是___。
的配比是___。
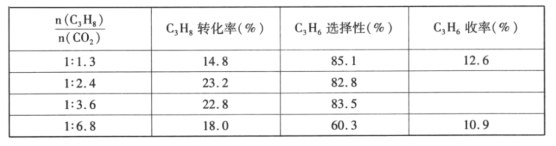
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
)常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。

回答下列问题:
(1)甲的分子式为___。
(2)丙中含有官能团的名称是___。
(3)反应①所需的试剂和条件是___;②的反应类型是___。
(4)丁的结构简式为___。
(5)写出丙与新制氢氧化铜悬浊液反应的化学方程式___。
(6)符合下列条件的乙的同分异构体共有___种。
①能发生银镜反应
②能与NaHCO3溶液反应
其中核磁共振氢谱峰面积之比为1∶1∶2∶6的一种同分异构体的结构简式为___(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家,一种高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法错误的是
LiFePO4+nC。下列说法错误的是
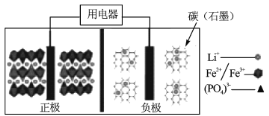
A.放电时,Li+向正极移动
B.放电时,电子由负极→用电器→正极
C.充电时,阴极反应为xLi++nC+xe-=LixCn
D.充电时,当溶液中通过1 mol e-时,阳极质量减小7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)基态Fe3+电子填充的最高能级符号为___________。
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有___________。含有12 mol σ键的KFe[Fe(CN)6]的物质的量为___________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________,与CN-互为等电子体的分子是________,离子是________。
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是_____________。
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴奋剂是体育比赛中禁用的药物,有一种兴奋剂的结构如图。关于它的说法中正确的是

A.该有机物能发生银镜反应
B.分子中有 4 个碳碳双键
C.既能被还原,又能被氧化
D.1mol 该物质最多跟 6mol 氢气发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com