
【题目】已知几种难溶电解质的溶度积如下表所示:
几种难溶电解质的Ksp(25℃) | |
沉淀溶解平衡 | Ksp |
AgBr(s) | 5,0×10-13 mol2·L-2 |
AgI(s) | 8.3×10-17 mol2·L-2 |
FeS(s) | 6.3×10-18 mol2·L-2 |
ZnS(s) | 1.6×10-24 mol2·L-2 |
CuS(s) | 1.3×10-36 mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺为:____________________。
(2)向饱和的AgI溶液中加入固体硝酸银,则c( I- )________(填“增大”、“减小”或“不变”),若改加AgBr固体,则c(Ag+)__________(填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是_____________________(用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡: ZnS(s)![]() Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
【答案】 AgBr>AgI>FeS>ZnS>CuS 减少 增大 CuS ZnS FeS CD
【解析】试题分析:(1)AgBr、AgI、FeS、ZnS、CuS结构相似,溶度积越大,溶解能力越强,AgBr>AgI>FeS>ZnS>CuS;(2)碘化银的溶度积不变,加入硝酸银,银离子浓度增大,所以[I-]减小;AgBr的溶度积大于碘化银的溶度积,所以加入AgBr,[Ag+]增大;(3)最先生成溶度积小的物质,生成的沉淀的先后顺序是CuS、ZnS、FeS;(4)ZnS 的溶度积大于CuS,故A错误;ZnS 的溶度积小于FeS,FeS 能转化为ZuS,故B错误;加入少量FeCl2固体,生成FeS,ZnS减少,故C正确;加入少量CuCl2固体,生成CuS,ZnS减少,故D正确;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中进行可逆反应2NO2![]() 2NO+O2,下列能作为反应达到平衡状态标志的是( )
2NO+O2,下列能作为反应达到平衡状态标志的是( )
①单位时间内生成nmol O2的同时生成2n mol NO2
②单位时间内生成n mol O2 的同时生成2n mol NO
③用NO2 、NO、O2表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变 ⑤混合气体的密度不再改变
⑥混合气体的压强不再改变 ⑦混合气体的平均相对分子质量不再改变
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是
A. 2 mol水的摩尔质量和1 mol水的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 标准状况下,22.4 L一氧化碳中氧原子数和16 g二氧化硫中氧原子数
D. 2 mol·L-1H2SO4溶液中的H+个数与1 mol·L-1HCl溶液中的H+个数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类一项重大贡献。
(1)现有如下两个反应:A.NaOH + HCl = NaCl + H2O, B.2FeCl3 + Cu = 2FeCl2 + CuCl2
判断能否设计成原电池A.__________B.____________。(填“能”或“不能”)
(2)由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生原电池腐蚀,一段时间后某电极产生3.36L标准状况下的气体。
①负极是_________(填“锌”或“铜”);
②正极的电极反应式为__________________________________;
③产生这些气体共需转移电子_________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气有广泛用途,工业上利用反应N2(g)+3H2(g)![]() 2NH3(g) H<0合成氨,回答以下问题:
2NH3(g) H<0合成氨,回答以下问题:
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①a条件下,0~t0的平均反应速率v(H2)=_____________mol·L-1·min-1。
②相对a而言,b可能改变的条件是________________。
③在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1时刻后c(H2)的变化曲线并作相应的标注。_____________
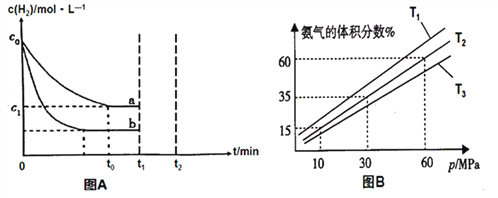
(2)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
① 比较T1、T3的大小T1__________T3(填“<”或“>”)。
②分析体系在T2、60MPa下达到的平衡,此时N2的平衡分压为_______MPa(分压=总压×物质的量分数);列式表示此时的平衡常数Kp=______________。(用平衡分压代替平衡浓度,不要求计算结果)
(3)有人利用NO2和NH3构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铜精炼,如图C所示,d极为粗铜。
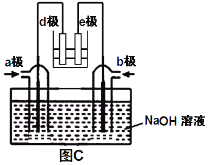
① a极通入________(填化学式);
② b极电极反应为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为1 L的容器中,通入一定量的N2 O4,在100℃时发生如下反应: N2O4(g)![]() NO2(g)ΔH>0,其N2O4和NO2浓度变化如图。
NO2(g)ΔH>0,其N2O4和NO2浓度变化如图。

(1)在0-60s这段时间内,以N2O4表示的平均反应速率为_______mol·L-1·s-1
(2)上述反应的平衡常数表达式为______,升高温度K值______ (填“增大"、“减小”或“不变”)
(3)反应进行到100s时,若有一项条件发生变化,变化的条件不可能是______ (填选项序号)。
A.降低温度 B.通人氦气使其压强增大 C.又往容器中充入N2O4 D.使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com