
海带中提取碘的实验方法:①称取3 g干海带,用刷子把干海带表面的附着物刷净;②将海带剪碎,用酒精润湿(便于灼烧)后,放在坩埚中;③用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,停止加热,冷却;④将海带灰转移到小烧杯中,再向烧杯中加入10 mL蒸馏水,搅拌,煮沸2~3 min,使可溶物溶解,过滤;⑤向滤液中滴入几滴硫酸,再加入约1 mL H2O2溶液,观察现象。下列说法正确的是
A.步骤①中也可以用水洗涤除去海带表面的附着物
B.步骤④过滤操作需要两种玻璃仪器
C .步骤⑤所得的溶液中加入淀粉可看到溶液变为蓝色
.步骤⑤所得的溶液中加入淀粉可看到溶液变为蓝色
D.通过以上①~⑤步骤即可得到纯度高的I2
科目:高中化学 来源:2016-2017学年河北省高一上第一次月考化学卷(解析版) 题型:选择题
两份质量相同的CH4和NH3相比较,下列结论错误的是
A.分子个数比为17:16 B.原子个数比为17:16
C.氢原子个数比为17:12 D.氢原子质量比为 17:12
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第三次月考化学卷(解析版) 题型:选择题
无色透明溶液中能大量共存的离子组是
A.Na+、Al3+、HCO3-、NO3- B.AlO2-、Cl-、Mg2+、K+
C.NH4+、Na+、CH3COO-、NO3- D.Na+、NO3-、ClO-、I-
查看答案和解析>>
科目:高中化学 来源:2017届河北省石家庄市高三上第一次阶段考试化学卷(解析版) 题型:实验题
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
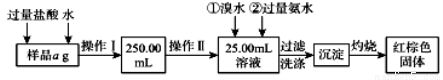
请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g。再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是 W1 g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。有同学提出,还可以采用以下方法来测定:

①溶解样品改用了硫酸,而不用盐酸,原因是 。
②选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
③若滴定用掉c mol/ L KMnO4溶液bmL,则样品中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源:2017届河北省石家庄市高三上第一次阶段考试化学卷(解析版) 题型:选择题
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是

A.该反应的还原剂是Cl-
B.消耗1 mol还原剂,转移6 mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源:2017届河北省石家庄市高三上第一次阶段考试化学卷(解析版) 题型:选择题
关于Na2CO3和NaHCO3的比较中,下列说法不正确的是
A.NaHCO3固体受热容易分解,而Na2CO3固体受热不容易分解
B.等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,前者消耗盐酸的物质的量比后者多
C.向等物质的量浓度的Na2CO3和NaHCO3溶液分别滴加2滴酚酞溶液,前者颜色比后者深
D.Na2CO3溶液和NaHCO3溶液分别与Ba(OH)2溶液反应的离子方程式相同
查看答案和解析>>
科目:高中化学 来源:2017届安徽省等四校高三上10月联考化学试卷(解析版) 题型:简答题
TiO2在工业生产和日常生活中有重要用途。
I、工业上用钛铁矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
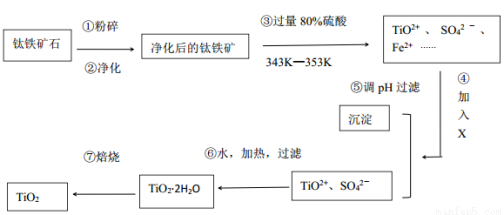
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)写出钛元素在周期表中的位置______________。
净化钛矿石时,是否需要除去杂质FeO?____ ________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式:____________________。
(3)④中加入的X可能是( )
A.H2O2 B.KMnO4 C.KOH D.SO2
(4)④⑤两步的目的是___________________________。
(5)写出⑥的化学反应方程式_____________________。
II、TiO2可通过下述两种方法制备金属钛:方法一是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(6)阴极反应的电极反应式为_____________________。
(7)电解过程中需定期向电解槽池中加入碳块的原因是__________________。
方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s) +2Cl2 (g) TiCl4(1)+O2 (g) △H= +151 kJ/mol
TiCl4(1)+O2 (g) △H= +151 kJ/mol
所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4。请从反应原理角度说明该反应难进行的原因__________________。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省等四校高三上10月联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.44.Og14CO2与14N2O的混合物中所含中子数为22NA
B.标准状况下,2.24L甲醛所含o键数目为0.3NA
C.常温常压下,4.5gH2O与足量Na2O2反应转移的电子数目为0.5 NA
D.50mL 18mol/L硫酸与足量Cu共热,转移的电子数为0.9NA
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次段考化学试卷(解析版) 题型:选择题
M、Q、R、V为分别占有前3周期的元素,其原子序数依次增加,M和R、Q和V属于同一主族,且它们的最外层电子数之和为14。下列说法中正确的是( )
A.单质的沸点:M>Q
B.Q元素的阴离子和V元素的阴离子都只有还原性[
C.M 、Q、R、V
、Q、R、V 四种元素组成的化合物的水溶液可以是
四种元素组成的化合物的水溶液可以是 碱
碱 性、中性和酸性
性、中性和酸性
D.Q与R可以组成2种离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com