
| A. | C4H10 | B. | C2H4 | C. | C4H8 | D. | C6H6 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 变化过程 | △H | △S |
| 4Fe(s)+3O2(g)=2Fe2O3(s) | <0 | |
| CaCO3(s)分解为CaO(s)和CO2(g) |
| 时间/min | A | B | C | D |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
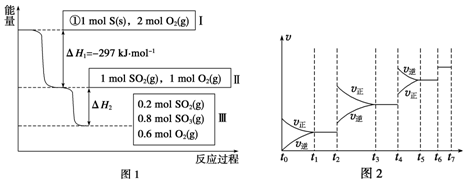
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{27m}{v}$mol/L | B. | $\frac{m}{9v}$mol/L | C. | $\frac{m}{27v}$mol/L | D. | $\frac{m}{18v}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②①⑤ | B. | ④⑤③②① | C. | ④③①②⑤ | D. | ④②③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5g | |
| B. | 32g氧气中含有2mol氧 | |
| C. | 58.5gNaCl中含有l mol NaCl分子 | |
| D. | 0.l mol二氧化碳含有6.02×1022个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液在电流作用下电离成Na+ 和Cl- | |
| B. | 蔗糖在水溶液里或熔融状态时均不导电,所以它不是电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 纯水的导电性很差,所以水不是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com