
���� ��1������ϩ����������ʵ����ֱ�Ϊxmol��ymol�����ݶ������ʵ���֮�������ɵ�ˮ��Hԭ���غ��з��̣��ݴ˼�����
��2������̼Ԫ���غ���㷴Ӧ��CO��CO2�����������ʵ���֮�ͣ��ݴ˼���b��ֵ���跴Ӧ��CO��CO2�����ʵ����ֱ�Ϊamol��bmol�����ݶ���֮������ԭ���غ��з��̼��㣻
��3������Hԭ���غ����ü������ֻ����ϩʱ��aֵ���ֻ������ʱ��aֵ��С��
��� �⣺��1������ϩ����������ʵ����ֱ�Ϊxmol��ymol�����ݶ������ʵ���֮����Hԭ���غ��з��̣���x+y=1��4x+6y=$\frac{45}{18}$����ã�x=0.5��y=0.5����n��C2H4����n��C2H6��=0.5mol��0.5mol=1��1���ʴ�Ϊ��1��1��
��2������̼Ԫ���غ��֪����Ӧ��CO��CO2�����������ʵ���֮��Ϊ1mol��2=2mol����$\frac{2}{3}$b=2��b=3��
�跴Ӧ��CO��CO2�����ʵ����ֱ�Ϊamol��bmol�����ݶ���֮������ԭ���غ��з��̣���a+b=2��a+2b=3��2-$\frac{45}{18}$����ã�a=0.5��b=1.5����n��CO����n��CO2��=0.5mol��1.5mol=1��3���ʴ�Ϊ��3��1��3��
��3������ˮ�����ʵ���=$\frac{45}{18}$mol=2.5mol��ֻ����ϩʱ��aֵ�����Hԭ���غ��֪��a�ļ���ֵΪ��$\frac{2.5mol��2}{4}$=$\frac{5}{4}$mol��ֻ������ʱ��aֵ��С������Hԭ���غ��֪��a�ļ�СֵΪ��$\frac{2.5mol��2}{6}$=$\frac{5}{6}$mol����a��ȡֵ��ΧΪ��$\frac{5}{6}$��a��$\frac{5}{4}$���ʴ�Ϊ��$\frac{5}{6}$��a��$\frac{5}{4}$��
���� ���⿼���˻���ﷴӦ�ļ��㣬��Ŀ�Ѷ��еȣ�ע�����������غ㶨�ɡ���ֵ���ڻ�ѧ�����е�Ӧ�ã�������ؿ���ѧ���ķ�����������������ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������10mlPH=12��NaOH��Һ�м���PH=2��HA��PH=7���õ���Һ�������V�R20ml | |
| B�� | �����к͵ζ�ʵ��ʱ����з�̪��NaOH��Һ�еμ���������Һǡ����ɫ����ʱ��ҺPH��7 | |
| C�� | ���������ˮ������Һ��C��NH4+����C��SO42-����C��H+����C��OH-�� | |
| D�� | PH��7�IJ������Һ��C��OH-��-C��H+��=4 C��H2C2O4��+2 C��HC2O4-��+2 C��C2O42-��-C��K+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
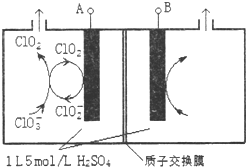 �������ȣ�ClO2���ǹ�����ϵĸ�Ч�����ס����١���ȫ����ɱ��������������Ϊ����4��������������ҵ�Ͽɲ��������ƣ�NaClO3�����������ƣ�NaClO2��Ϊԭ���Ʊ�ClO2��
�������ȣ�ClO2���ǹ�����ϵĸ�Ч�����ס����١���ȫ����ɱ��������������Ϊ����4��������������ҵ�Ͽɲ��������ƣ�NaClO3�����������ƣ�NaClO2��Ϊԭ���Ʊ�ClO2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH���� | B�� | NaCl���� | C�� | MgSO4���� | D�� | NaHSO4���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
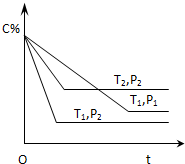 ��֪ij���淴Ӧ��mA������+nB������?xC��������H=QkJ•mol-1�����ܱ������н��У���ͼ��ʾ��Ӧ�ڲ�ͬʱ��t���¶�T��ѹǿP��C�ڻ�������еİٷֺ�����C%���Ĺ�ϵ���ߣ�������
��֪ij���淴Ӧ��mA������+nB������?xC��������H=QkJ•mol-1�����ܱ������н��У���ͼ��ʾ��Ӧ�ڲ�ͬʱ��t���¶�T��ѹǿP��C�ڻ�������еİٷֺ�����C%���Ĺ�ϵ���ߣ�������| A�� | T1��T2��P1��P2��m+n��x��Q��0 | B�� | T1��T2��P1��P2��m+n��x��Q��0 | ||
| C�� | T1��T2��P1��P2��m+n��x��Q��0 | D�� | T1��T2��P1��P2��m+n��x��Q��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl�ĵ���ʽ��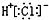 | B�� | �����ӣ�Cl-���Ľṹʾ��ͼ�� | ||
| C�� | ����Ľṹ��ʽ��C2H4O2 | D�� | ������Ϊ17��������Ϊ20����ԭ�ӣ�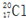 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com