
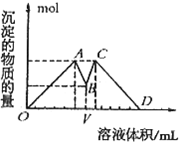
 如图所示是向MgCl2、AlCl3混合液中依次加入M和N时生成沉淀的物质的量与加入的M和N的体积关系图(M、N各表示盐酸或氢氧化钠溶液中的一种),以下结论不正确的是( )
如图所示是向MgCl2、AlCl3混合液中依次加入M和N时生成沉淀的物质的量与加入的M和N的体积关系图(M、N各表示盐酸或氢氧化钠溶液中的一种),以下结论不正确的是( )| A、混合溶液中c(AlCl3):c(MgCl2)=1:1 | B、混合溶液中c(AlCl3):c(MgCl2)=3:1 | C、V之前加NaOH溶液,V之后加盐酸 | D、这种盐酸与NaOH溶液中溶质的物质的量浓度相同 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某同学设计了如下两种制备氢氧化铝的方案:
某同学设计了如下两种制备氢氧化铝的方案:| 100mL盐酸 |
| NaOH溶液 |
| 100mLNaOH |
| HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高二化学(上) 题型:021
如图所示是向100mL的盐酸中逐滴加入NaOH溶液时,溶液中pH变化的图像,由图像得出的正确结论为

[ ]
|
A.原溶液中c(HCl)=0.1mol·L-1 |
B.x=0.1mol |
|
C.原溶液中c(HCl)=1mol·L-1 |
D.x=0.01mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

A.A是盐酸,B是NaOH,且c(NaOH)=2c(HCl)
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶1∶5
C.A是NaOH,B是盐酸,且c(NaOH)∶c(HCl)=2∶1
D.从6到9,相应离子反应方程式为:H++OH-====H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com