
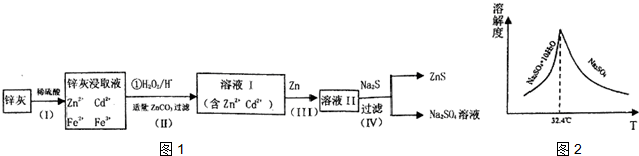
分析 锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的滤液Ⅰ和滤渣Fe(OH)3、ZnCO3;步骤Ⅲ中加入锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌,
(1)根据有效化学反应速率的因素分析,如搅拌、适当升温、将废渣碾细成粉末、搅拌、多次浸取等都可提高锌灰的浸取率;
(2)用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,根据上面的分析判断步骤Ⅱ所得滤渣的组成;
(3)①等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒写出该化学反应方程式;
②根据溶解度随温度变化曲线分析从滤液中得到Na2SO4.10H2O的操作方法;
(4)步骤Ⅲ所得Cd为d mol,则用于置换镉的锌的物质的量为d mol,硫酸钠的物质的量为:VL×c mol/L=cVmol,所以硫酸锌的物质的量为cVmol,根据锌元素守恒可知,样品中锌元素的物质的量,然后根据m=nM计算出锌灰中含有锌元素的质量.
解答 解:锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的滤液Ⅰ和滤渣Fe(OH)3、ZnCO3;步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌,
(1)搅拌、适当升温、将废渣碾细成粉末、搅拌、多次浸取等都可提高锌灰的浸取率,故选①②③⑤;
(2)根据上面的分析可知,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,反应的离子方程式为ZnCO3+2H+=Zn2++CO2↑+H2O、Fe3++3H2O=Fe(OH)3↓+3H+,所以步骤Ⅱ所得滤渣为Fe(OH)3、ZnCO3,
故答案为:ZnCO3+2H+=Zn2++CO2↑+H2O、Fe3++3H2O=Fe(OH)3↓+3H+;Fe(OH)3、ZnCO3;
(3)①等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒可知,该化学反应方程式为:Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2,
故答案为:Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2;
②根据溶解度随温度变化曲线可知,从滤液中得到Na2SO4.10H2O的操作方法是蒸发浓缩,降温结晶,过滤,
故答案为:蒸发浓缩,降温结晶,过滤;
(4)步骤Ⅲ所得Cd为d mol,则用于置换镉的锌的物质的量为d mol,硫酸钠的物质的量为:VL×c mol/L=cVmol,所以硫酸锌的物质的量为cVmol,
根据锌元素守恒可知,样品中锌元素的物质的量为:cVmol-d mol-b mol,
所以锌灰中含有锌元素的质量为:65g/mol×(cVmol-d mol-b mol)=65(Vc-b-d)g,
故答案为:65(Vc-b-d)g.
点评 本题为工艺流程题,通过从废渣中制取硫化锌的工艺流程,考查了溶解平衡的移动、氧化还原方程式的书写、物质的分离等知识,熟悉物质的性质、明确流程是解题关键,试题侧重学生分析问题、解决问题能力的培养,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
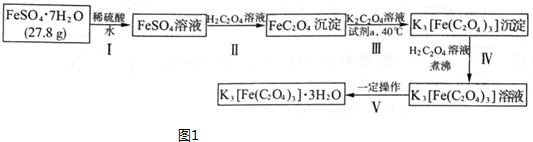
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
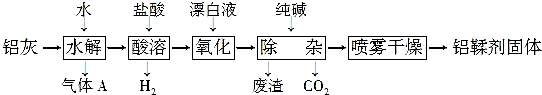
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
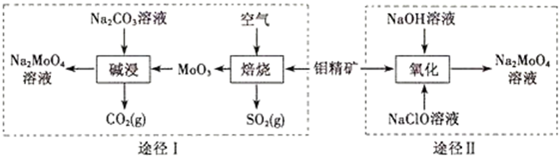

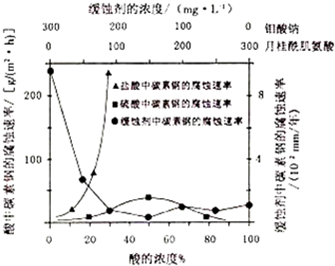
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属铝进行铝热法炼铁 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用水玻璃制备硅胶和木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
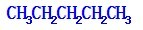 ;
;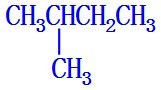 ;
;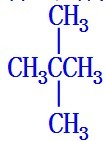 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com