
【题目】下列关于有机物的说法正确的是
A. 乙醇和乙酸均可与NaOH溶液发生酸碱中和反应
B. 苯分子中存在典型的碳碳双键,可发生加成反应
C. 苯分子能发生取代反应
D. 加热银氨溶液与淀粉溶液的混合液可用于检验淀粉
科目:高中化学 来源: 题型:
【题目】现有21.6 g由CO和CO2组成的混合气体,在标准状况下其体积为13.44 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)混合气体中碳原子的质量为________。
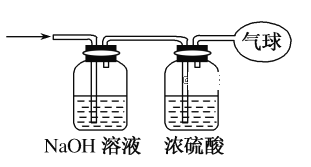
(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
①气球中收集到的气体的摩尔质量为________。
②气球的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在实验室制取 Na2O2。查阅资料可知:钠与空气在 453473K 之间可生成 Na2O,迅速提高温度到 573673K 之间可生成 Na2O2,若温度提高到 733873K 之间 Na2O2 可分解。
(1)甲组设计制取 Na2O2 装置如图1。
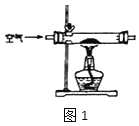
①使用该装置制取的 Na2O2 中可能含有的杂质为_____。.
A.NaCl B.Na2CO3 C.Na2O D.NaOH E.NaHCO3
②该小组为测定制得的 Na2O2 样品的纯度,设计可能用到的装置如图 2:烧瓶中发生的主要反应的化学方程式是_________。测定装置的接口从 左至右正确的连接顺序是_____。

(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果_____ (填“偏大”或“偏 小”)。为证明其分析的正确性,设计实验方案如下:
实验方案 | 产生的现象 |
Ⅰ.取烧瓶中的反应液加入少量 MnO2 粉末 | 有大量气泡逸出 |
Ⅱ.向 NaOH 稀溶液中加入 23 滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色开始无明显现象。 |
Ⅲ.向反应液中加入 23 滴酚酞试液,充分振荡,然后逐滴加入 过量的 NaOH 稀溶液 | 加 NaOH 溶液先 变红后褪色 |
在上述实验中,能够证明乙组分析正确的最佳方案是_________ (填实验序号)。_______________组实验得不出结论,原因是_____。
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度。请简述实验操作和需 要测定的有关数据__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 在常温常压下,11.2L Cl2含有的分子数为0.5NA
C. 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
D. 标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中少量杂质所需除杂试剂及方法不正确的是( )
物质(杂质) | 除杂试剂 | 除杂方法 | |
A | 乙醇(水) | CaO | 蒸馏 |
B | 淀粉溶液(NaCl) | ——— | 渗析 |
C | CO2(HCl) | NaOH溶液 | 洗气 |
D | NaCl溶液(I2) | CCl4 | 萃取分液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) H1=a kJmol-1
②2NO(g)+2CO(g) N2(g)+ 2CO2(g) H2=b kJmol-1
则反应N2(g)+ O2(g)= 2NO(g)的H=____________kJmol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 ____________。
②在该温度下反应的平衡常数K=________。
③关于上述反应,下列叙述不正确的是_______(填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆
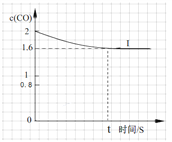
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。______________
(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图
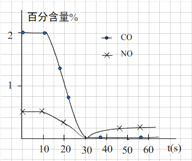
请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同。

回答下列问题:
(1)A与E形成的化合物的化学式是 __________________。
(2)B的最高价氧化物化学式为____________,C的元素名称为 ___________________ 。
(3)D的单质与水反应的方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.0mL 0.10 mol·L-1某二元酸H2R溶液中滴加入同物质的量浓度的NaOH溶液,测得溶液的pH随NaOH溶液体积的变化如右图所示。下列说法中正确的是
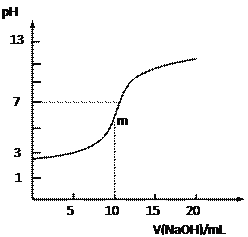
A. 无法判断H2R是强酸还是弱酸
B. 曲线上m点时溶液中c(Na+)>c(HR-) >c(R2-)>c(H+)
C. HR-的电离能力大于水解能力
D. 溶液中c(Na+)+c(H+)=c(HR-)+c(R2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三鹿奶粉事件”在社会上引起了人们对食品质量的恐慌,三鹿奶粉中被掺杂了被称为“蛋白精”的工业原料三聚氰胺。已知三聚氰胺的结构简式如图所示。三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题:

(1)写出基态碳原子的电子排布式______________。
(2)氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是__________、__________、__________。
(3)一个三聚氰胺分子中有______个σ键。
(4)三聚氰胺与三聚氰酸(![]() )分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取________杂化。该分子的结构简式中,每个碳氧原子之间的共价键是__________(填选项)。
)分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取________杂化。该分子的结构简式中,每个碳氧原子之间的共价键是__________(填选项)。
A.2个σ键 B.2个π键 C.1个σ键,1个π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com