
【题目】金晶体的晶胞为面心立方堆积,如图所示。设金原子的直径为d,用NA表示阿伏加德罗常数,在立方体的各个面的对角线上,3个金原子彼此两两相切,M表示金的摩尔质量。则下列说法错误的是( )

A.金晶体每个晶胞中含有4个金原子
B.金属键无方向性,金属原子尽可能采取密堆积
C.一个晶胞的体积是16![]() d3
d3
D.金晶体的密度是![]()
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
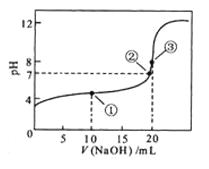
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线____填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H= _________________________ 。
CH3OH(g)的△H= _________________________ 。
(2)下列说法正确的是 (_________)
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,υ(CO)= _______;达到平衡时,c(H2)= ____ ,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理含氮的化合物,在生产、生活中有重要意义。回答下列问题:
(1)在紫外光照射的条件下,氯气与偏二甲肼[(CH3)2NNH2]可快速反应,偏二甲肼转化为CH3OH和N2,该反应的化学方程式为______________________________。
(2)连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。25℃时,连二次硝酸的电离常数Ka1=6.17×10-8,Ka2=2.88×10-12
①25℃时0.1molL-1NaHN2O2溶液中离子浓度由大到小的顺序为____________________________。
②25℃时向0.1 molL-1连二次硝酸溶液中逐滴滴入NaOH溶液,当溶液的pH=10时,C(N2O22-)/ C(H2N2O2)=________。
(3)亚硝酰氯可由NO与Cl2反应制得,反应原理为2NO(g)+ Cl2 (g)![]() 2C1NO(g)。按投料比n(NO):n(Cl2) =2:1把NO和Cl2充入一恒压的密闭容器中发生上述反应,NO的平衡转化率与温度T的关系如图所示:
2C1NO(g)。按投料比n(NO):n(Cl2) =2:1把NO和Cl2充入一恒压的密闭容器中发生上述反应,NO的平衡转化率与温度T的关系如图所示:
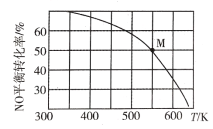
①该反应的△H_____(填“>”“<”或“=”)0。
②M点时容器内NO的体积分数为____。
③若反应一直保持在P压强条件下进行,则M点的平衡常数Kp=____________,(用含P的表达式表示)。
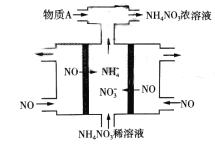
(4)工业上电解NO制备NH4NO3可以变废为宝,其工作原理如图所示、电解时阳极反应式为___________,为使电解产物全部转化为NH4NO3,需要补充物质A,物质A化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有单质A、B、C及化合物D、E、F、G、H,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
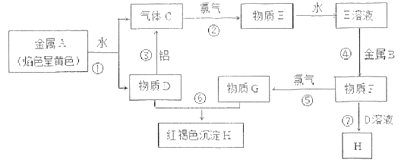
请根据以上信息回答下列问题:
(1)反应③是D物质的水溶液与金属铝反应,金属铝被氧化___(写化学式);
(2)步骤⑦中刚生成的白色沉淀颜色会迅速发生变化,最终生成红褐色沉淀H,请写出由白色沉淀变成H的化学方程式:___;
(3)检验G中所含的金属离子时,在G溶液中加入硫氰化钾溶液,离子方程式为:___;
(4)工业上将氯气通入D溶液中制取消毒液,反应的化学方程式为___,1mol氯气发生反应,转移电子___mol;消毒液中的有效成分是___(填名称);
(5)将0.1molA的碳酸盐溶液和0.15molE溶液混合,有如下两种方式:
A.将含A的碳酸盐溶液逐滴加入到E溶液中;
B.将E溶液逐滴加入到含A的碳酸盐溶液中;
理论上产生气体比较多的是___(填序号),多___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水淡化是解决沿海城市饮用水问题的关键技术。下图是电渗析法淡化海水装置的工作原理示意图(电解槽内部的“┆”和“│”表示不同类型的离子交换膜)。工作过程中b电极上持续产生Cl2。下列关于该装置的说法错误的是
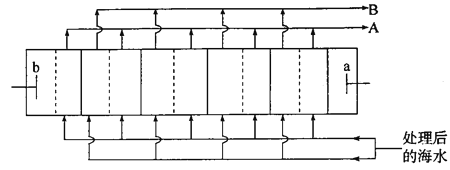
A. 工作过程中b极电势高于a极
B. “┆”表示阴离子交换膜,“│”表示阳离子交换膜
C. 海水预处理主要是除去Ca2+、Mg2+等
D. A口流出的是“浓水”,B口流出的是淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )

A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com