


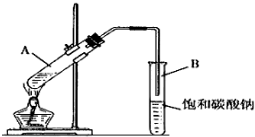
分析 (1)图1中A为滴定管,液面介于21~22mL之间,B为量筒,仰视时,滴定管读数偏大,量筒读数偏小;
(2)①加热固体所用仪器为坩埚;
②将溶液中的I- 氧化为I2,注意不能引入杂质;
③一般用苯、四氯化碳作萃取剂;
④从碘的有机溶液中回收有机溶剂,应用蒸馏的方法分离;
(3)①检验是否沉淀完全实际上就是检验是否含有氯离子,所以可以向反应后的溶液中加入硝酸银,然后进行判断;
②固体具有吸附作用,如没有洗涤干净,可导致固体质量偏大;可检验洗涤液是否含有氯离子来检验是否洗涤干净;
③bg为CaCO3的质量,以此可知Na2CO3的质量,进而计算质量分数.
解答 解:(1)图1中A为滴定管,液面介于21~22mL之间,滴定管刻度由上到下逐渐增大,由图可知体积读数为21.60mL,B为量筒,刻度从下到上增大,仰视时,滴定管读数偏大,量筒读数偏小,故答案为:21.60;滴定管;
(2)①将海带灼烧灰化所需瓷质仪器为坩埚,故答案为:坩埚;
②将溶液中的I- 氧化为I2,注意不能引入杂质,应选用酸性过氧化氢溶液,故答案为:D;
③苯、四氯化碳不溶于水,且碘在苯、四氯化碳中的溶解度较大,一般用苯、四氯化碳作萃取剂,故答案为:苯、四氯化碳等;
④从碘的有机溶液中回收有机溶剂,应用蒸馏的方法分离,故答案为:B;
(3)①检验是否沉淀完全实际上就是检验是否含有氯离子,所以可以向反应后的溶液中加入硝酸银,如果没有沉淀完全则会有沉淀产生,
故答案为:取少量反应后的溶液,滴加AgNO3溶液,无沉淀生成,则沉淀完全;
②固体具有吸附作用,如没有洗涤干净,可导致固体质量偏大;可检验洗涤液是否含有氯离子来检验是否洗涤干净,操作方法是取少量最后一次洗涤液与小试管中,加入硝酸酸化的硝酸银,如没有沉淀生成,则说明洗涤干净,
故答案为:偏大;取少量最后一次洗涤液与小试管中,加入硝酸酸化的硝酸银,如没有沉淀生成,则说明洗涤干净;
③bg为CaCO3的质量,由Na2CO3~CaCO3可知,n(Na2CO3)=n(CaCO3)=$\frac{b}{100}$mol,则m(Na2CO3)=$\frac{106b}{100}$g,
则ω(Na2CO3)=$\frac{\frac{106b}{100}}{a}×100%$=$\frac{106g}{a}%$,
故答案为:$\frac{106g}{a}%$.
点评 本题综合考查物质含量的测定,分离以及定量仪器的使用等知识,为高考常见题型,侧重学生的分析、实验和计算能力的考查,注意把握实验的基本操作以及实验原理,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Q2<$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2=$\frac{{Q}_{1}}{2}$ | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)写出制取乙酸乙酯的化学反应方程式CH3COOH+CH3CH2OH
(1)写出制取乙酸乙酯的化学反应方程式CH3COOH+CH3CH2OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
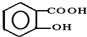 ,请回答下列问题:
,请回答下列问题: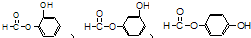 ;
;
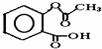 ,1摩尔阿司匹林与NaOH完全反应需要氢氧化钠3mol.
,1摩尔阿司匹林与NaOH完全反应需要氢氧化钠3mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物与还原产物粒子个数比是2:5 | |
| B. | 被氧化的盐酸占参加反应盐酸总数的$\frac{5}{8}$ | |
| C. | KMnO4只有一部分发生还原反应 | |
| D. | KMnO4与HCl恰好分别完全发生还原反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
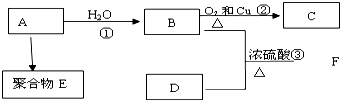
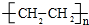 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
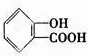 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com