
���� ��1��Cu2+Ϊ��ɫ������ɫ������
��2���������ϡ���ᣬ�а�ɫ�������ɣ��ټ������ϡ���ᣬ��ɫ��������ʧ����ɫ����ΪAgCl��
��3��ȡ��2������Һ�������NaOH��Һ�����ְ�ɫ��������ɫ����Ϊ������þ��
��4��Ag+��Cl-������ɳ�����Ag+��Mg2+����CO32-��OH-��Ӧ���ɳ�����
��� �⣺��1��Cu2+Ϊ��ɫ������ɫ�����������κ�ʵ��Ϳ��Կ϶�ԭ��Һ�в����ڵ�������Cu2+���ʴ�Ϊ��Cu2+��
�������ϡ���ᣬ�а�ɫ�������ɣ��ټ������ϡ���ᣬ��ɫ��������ʧ����ɫ����ΪAgCl����֪��Һ�д���Ag+���ʴ�Ϊ��Ag+��
��3��ȡ��2������Һ�������NaOH��Һ�����ְ�ɫ��������ɫ����Ϊ������þ����֪��Һ�д���Mg2+���ʴ�Ϊ��Mg2+��
��4��Ag+��Cl-������ɳ�����Ag+��Mg2+����CO32-��OH-��Ӧ���ɳ�����������������Ӳ���Ӧ����ԭ��Һ�п��ܴ������ڵ���������NO3-���ʴ�Ϊ��B��
���� ���⿼�鳣�����ӵļ��飬Ϊ��Ƶ���㣬�������ӵļ��顢�����ķ�Ӧ������Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע�����ӷ�Ӧ��Ӧ�ã���Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
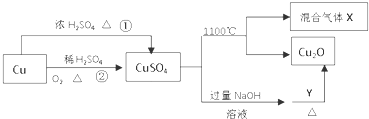
| A�� | �����;���٣�;���ڸ��õ���������ɫ��ѧ˼�� | |
| B�� | Y������������ | |
| C�� | CuSO4��1100��ֽ����û������X������SO2��SO3 | |
| D�� | CuSO4����������ũҩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ���������� | B�� | ����������Һ���������� | ||
| C�� | �Ȼ�ͭ��Һ���Ȼ�ͭ | D�� | ��������Һ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaCl NaClO HCl | B�� | KCl KClO HClO | ||
| C�� | Na2S Na2SO3 H2SO3 | D�� | K2S K2SO3 H2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �٢� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4+ NO3- CO32- Na+ | B�� | Na+ Ba2+ Mg2+ HCO3- | ||
| C�� | NO3- Ca2+ K+ Cl- | D�� | NO3- K+[Al��OH��4]- H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
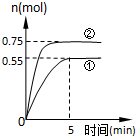 ̼ѭ����;��֮һ�ǣ�CO2��g��+3H2��g��?CH3OH��g��+H2O��g��+49.0kJ�����ݻ�Ϊ2L���ܱ������г���1mol CO2��3mol H2�������ֲ�ͬ��ʵ�������½��з�Ӧ�����CH3OH��g�������ʵ�����ʱ��仯�����ͼ��ʾ��
̼ѭ����;��֮һ�ǣ�CO2��g��+3H2��g��?CH3OH��g��+H2O��g��+49.0kJ�����ݻ�Ϊ2L���ܱ������г���1mol CO2��3mol H2�������ֲ�ͬ��ʵ�������½��з�Ӧ�����CH3OH��g�������ʵ�����ʱ��仯�����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ����ǽ�����ת��Ϊ��ѧ�ܵ�װ�� | |
| B�� | ���������ķ�ӦΪ��Fe-2e-=Fe 2+ | |
| C�� | ���������ķ�ӦΪ��2H2O+O2+2e-=4OH- | |
| D�� | ������ˮ�µIJ��ֱ��ڿ�����ˮ�����������ʴ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com