
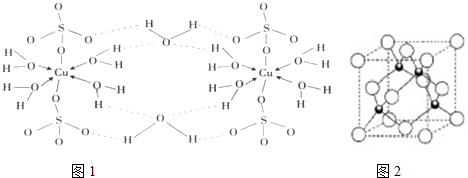
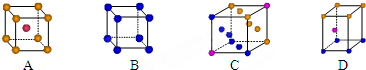
分析 (1)①Cu的原子序数为29,结合能量最低原理书写电子排布式;Cu为最密堆积,配位数为12;
②根据胆矾晶体的结构图可知,在晶体中水分子与铜离子之间是配位键,氢氧之间是极性共价键,硫酸根和铜离子之间为离子键,水分子与水分子之间有氢键,据此答题;
③铜离子与水分子通过配位键形成水合铜离子[Cu(H2O)4]2+;
(2)①同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
②氨气中N原子的价层电子对数为$\frac{5+3}{2}$=4,据此判断;
(3)根据均摊法,可以写出晶胞中所含原子的个数,进而确定化学式;
解答 解:(1)①Cu的原子序数为29,电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,Cu为最密堆积,配位数为12,C符合,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1; C;
②根据胆矾晶体的结构图可知,在晶体中水分子与铜离子之间是配位键,氢氧之间是极性共价键,硫酸根和铜离子之间为离子键,水分子与水分子之间有氢键,
故答案为:abde;
③铜离子与水分子通过配位键形成水合铜离子[Cu(H2O)4]2+,离子方程式为Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+;
(2)①同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由小到大的顺序为:C<O<N,
故答案为:C<O<N;
②氨气中N原子的价层电子对数为$\frac{5+3}{2}$=4,所以N原子的杂化方式为sp3,
故答案为:sp3;
(3)根据均摊法,可知晶胞中含Cl原子的个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cu原子个数为4,所以氯原子和铜原子个数比为1:1,所以化学式为CuCl,
故答案为:CuCl;
点评 本题考查核外电子排布式、化学键、原子的结构与性质关系、杂化、晶胞的计算以及学生读图表提取信息能力,题目难度中等,旨在考查学生对知识的掌握与利用.


科目:高中化学 来源: 题型:选择题
| A. | 9.0 | B. | 9.5 | C. | 1 0.5 | D. | 1 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm互为同位素 | |
| B. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm是同一种核素 | |
| D. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 磷酸二氢根电离的离子方程式:H2PO4-+H2O?H3O++HPO42- | |
| C. | 少量碳酸氢钙溶液与氢氧化钠溶液混合的离子方程式Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| D. | 在0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:CrO72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Z |
| A. | 离子半径:r(Y)>r(Z)>r(W) | |
| B. | Z的简单离子能破坏水的电离平衡 | |
| C. | XWm与YWn中化学键类型相同(m、n为正整数) | |
| D. | 元素Z的简单气态氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C、136C、146C为碳元素的三种核素.元素周期表中碳的相对原子质量为12.01,说明自然界中的碳主要以126C的核素形式存在 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,加快该反应的速率,却不能提高该反应的平衡转化率 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 | |
| D. | 绿色荧光蛋白在研究癌症发病机制的过程中应用突出,但其在酸性或碱性条件下可能会失去发光功能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:丙>丁>乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | NH3 | CO2 |
| B | Cl2 | CO2 |
| C | SO2 | NO2 |
| D | Cl2 | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y>Z>W | |
| B. | 简单氢化物的热稳定性:X>Y>R | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | R的最高价氧化物对应的水化物化学式一定是HRO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com