
| 10.2g |
| 102g/mol |
| 0.02mol |
| 1mol?L-1 |
| 0.62mol |
| 1mol?L-1 |
| 0.82mol |
| 1mol?L-1 |


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| A、青石棉是一种硅酸盐材料 |
| B、青石棉中含有一定量的石英晶体 |
| C、青石棉的化学组成可表示为Na2O?3FeO?Fe2O3?8SiO2?H2O |
| D、1 mol青石棉能将含1 mol HNO3的稀硝酸还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 反应的化学方程式为 ① | |
| 乙小组 | 浓氨水、氢氧化钠固体 | 氢氧化钠的作用:氨水中存在平衡:NH4++OH-?NH3?H2O?NH3+H2O,NaOH固体溶于水,使溶液中c(OH-)增大,平衡向右移动,且NaOH固体溶于水时放热,溶液温度升高,平衡向右移动. |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、点燃氢气前要检验氢气的纯度,以免发生爆炸 |
| B、不慎将浓盐酸沾到皮肤上,要立即用浓碱溶液冲洗 |
| C、CO气体有毒,处理CO尾气时可将其点燃,转化为无毒的CO2 |
| D、如果少量酒精失火燃烧,可用湿抹布盖灭火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
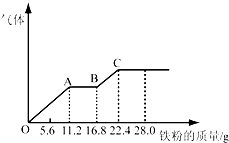 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示.下列分析或结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示.下列分析或结果不正确的是( )| A、混合酸中HNO3物质的量浓度为2mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| C、原混合酸中H2SO4物质的量为0.4 mol |
| D、第二份溶液中最终溶质为FeSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com