
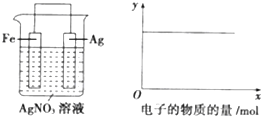
| A、c(Ag+) |
| B、c(NO3-) |
| C、Ag棒的质量 |
| D、溶液的质量 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 |
| B、在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
| C、任何离子键在形成的过程中必定有电子的得与失 |
| D、离子化合物中不一定含金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验目的 | |
| A | C2H4与SO2混合气体通过盛有溴水的洗气瓶 | 除去C2H4中的SO2 |
| B | 先滴加NaOH溶液后过滤 | 除苯中的苯酚 |
| C | 用蒸馏法分离丁醇与乙醚 | 除去丁醇中的乙醚 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等体积的pH=3的醋酸溶液和pH=4的醋酸溶液完全中和时消耗氢氧化钠的物质的量,前者是后者的10倍 |
| B、向0.1mol/L的氨水里,加入0.1mol/L的HCl溶液至反应pH=7时,消耗HCl溶液的体积小于氨水的体积 |
| C、pH=3的0.1mol/L HX与0.1mol/L NaX的混合溶液中,2c(Na+)=c(X-) |
| D、0.1mol/L的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,17g NH3所含的氮原子数为NA |
| B、物质的量浓度为0.5 mol/L MgCl2溶液,含有Cl-离子数为NA |
| C、标准状况下,22.4 LH2O的分子数为NA |
| D、64 g SO2含有氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(C)=0.2 mol?L-1?S-1 |
| B、z=3 |
| C、B的转化率为25% |
| D、C平衡时的浓度为0.5mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com