
【题目】下列各组离子在溶液中能大量共存的是
A. Al3+、Na+、HCO3-、[Al(OH)4]-
B. Ca2+、HCO3-、Cl-、K+
C. Fe3+、H+、SO42-、S2-
D. Fe2+、NO3-、Na+、H+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下面是混合物分离的实验,请回答有关问题
实验:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示
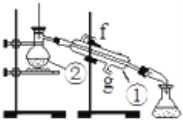
(1)写出下列仪器的名称:①________②________。
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是________,图中装置中进水口是________。(填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.84 gcm﹣3、溶质的质量分数为98 %的硫酸,配制250 mL物质的量浓度为0.46 molL﹣1的硫酸。
(1)98 %的浓硫酸的物质的量浓度为_____。
(2)现有下列几种规格的量筒,应选用_____(填序号)。
①5 mL量筒 ②10 mL量筒 ③50 mL量筒 ④100 mL量筒
(3)实验需要以下步骤:①定容②量取③摇匀④洗涤⑤转移⑥冷却⑦计算⑧装瓶⑨稀释进行顺序为_____。
A. ⑦②④⑨⑥③⑤①⑧ B.⑦②⑥⑨⑤④③①⑧
C.⑦②⑨⑥⑤④①③⑧ D. ⑦②⑨⑥④⑤③①⑧
(4)下列操作使所配溶液的物质的量浓度偏高的是______。
A.往容量瓶中转移溶液时有少量液体溅出
B.未洗涤稀释浓H2SO4的小烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。

甲池 乙池
(1)B是铅蓄电池的________极,放电过程中A电极反应式:_______________________。
(2)电解后甲池中电解液的pH________(填“减小”“增大”或“不变”)。若甲池中产生气体11.2L(标准状况下),此时乙池中理论上Zn电极最多产生固体________ g。
(3)乙池中 C(碳)电极是_________极。C电极的电极反应式是___________________,反应一段时间后,向乙池中加入一定量的___________(填化学式)固体,能使CuSO4溶液恢复到原浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ、稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的离子反应方程式_________________________________。
Ⅱ、常温下,向20mL 0.2molL﹣1H2A溶液中滴加0.2molL﹣1NaOH溶液.有关微粒的物质的量变化如下图(Ⅰ代表H2A,Ⅱ代表HA﹣,Ⅲ代表A2﹣)

(1)H2A在水中的电离方程式为_________________________。
(2)当V(NaOH)=20 mL时,写出H2A与NaOH反应的离子方程式_________________。此时溶液中所有离子浓度大小关系:__________________。
(3)向NaHA溶液中加水,HA﹣的电离度_________、溶液的pH________。(填增大、减小、不变、无法确定)。
(4)V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)﹣2c(OH﹣)________2c(A2﹣)﹣3c(H2A)﹣c(HA﹣)(填“<”“>”或“=”)。
(5)某校研究性学习小组开展了题为“H2A是强酸还是弱酸的实验研究”的探究活动。该校研究性学习小组设计了如下方案:你认为下述方案可行的是_______(填编号);
A.测量浓度为0.05 mol/L H2A溶液的pH,若pH大于1,则可证明H2A为弱电解质
B.可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.比较中和等体积、等物质的量浓度的硫酸和H2A溶液所需氢氧化钠的量多少,可证明H2A是强酸还是弱酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A和E可以合成芳香酯I,合成路线如图所示:
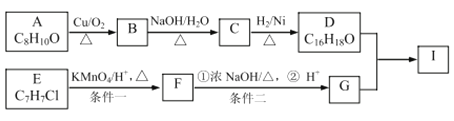
已知:
①![]()
②2RCH2CHO![]()
③B的苯环上只有一个取代基,且能发生银镜反应;
④E的核磁共振氢谱有3组峰
请回答下列问题:
(1)A的结构简式为________,B的化学名称是________ 。
(2)C→D的反应类型为________,F中所含官能团的名称是________ 。
(3)条件一与条件二能否互换____(填“能”或“否”),原因是_________ 。
(4)写出D与G反应的化学方程式_______________ 。
(5)A的同分异构体很多,其中能使FeCl3溶液显紫色有___种,写出其中一种核磁共振氢谱有4组峰的分子的结构简式________ 。
(6)结合题中信息,写出以溴乙烷为原料制备1-丁醇的合成路线图______ (无机试剂任选),合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用蒸馏水稀释1mol/L氨水至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是
A. c(OH-)/ c(NH3·H2O) B. c(NH![]() )/ c(OH-)
)/ c(OH-)
C. c(NH3·H2O)/ c(NH![]() ) D. c(OH-)
) D. c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4﹣O2燃料电池具有放电稳定,无污染等优点,如图用甲烷氧气燃料电池电解饱和氯化钠溶液的模型图,其中氯化钠溶液滴有酚酞试液。已知甲烷氧气燃料电池的总反应式为:CH4+2O2+2KOH K2CO3+3H2O请认真读图,回答以下问题:
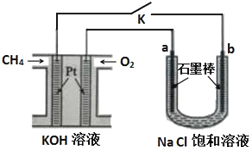
(1)请写出通入甲烷气体的一极所发生的电极反应式:____________________,其附近的pH值________(填“不变”或“变大”或“变小”) 通入O2气体的一极所发生的电极反应式:_______________,其附近的pH值________(填“不变”或“变大”或“变小”)。
(2)a为_______极,电极反应式为______________;b为_______极,电极反应式为_________________,现象是_______________;总方程式为 ____________________________。
(3)如果通入1mol的甲烷完全参与电极反应,则电路中转移___________mol的电子,a电极产生的气体在标准状况下的体积为______________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:

已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com