
| A. | 18g D2O含有电子数为10NA | |
| B. | 常温下,4.6 g Na和足量的O2完全反应失去电子数为0.2NA | |
| C. | 标准状况下,11.2 LNO和11.2 L O2混合后气体的分子总数为NA | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
分析 A、求出重水的物质的量,然后根据1mol重水中含10mol电子来分析;
B、求出钠的物质的量,然后根据反应后钠变为+1价来分析;
C、NO和氧气反应后生成的NO2中存在平衡:2NO2?NO2;
D、溶液体积不明确.
解答 解:A、18g重水的物质的量为0.9mol,而1mol重水中含10mol电子,故0.9mol重水中含9NA个电子,故A错误;
B、4.6g钠的物质的量为0.2mol,而反应后钠变为+1价,故0.2mol钠失去0.2NA个电子,故B正确;
C、NO和氧气反应后生成的NO2中存在平衡:2NO2?NO2,导致分子个数减小,故混合后气体分子总数小于NA个,故C错误;
D、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 溶液 | 粒子浓度关系 |
| A | CH3COOK溶液中加入少量NaNO3固体后 | c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| B | 新制氯水 | c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C | NH4HSO4溶液 | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) |
| D | 0.1mol•L-1,pH为4的NaHB溶液 | c(HB-)>c(H2B)>c(B2-) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
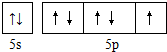 .
.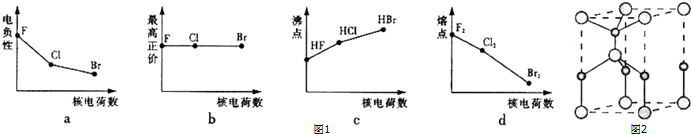
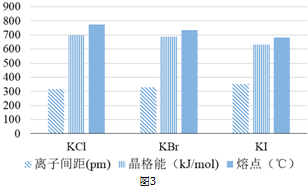
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
己知:60℃ 时,KNO3的溶解度为110g。在此温度下,向盛有l00mL水的烧杯中投入101g KNO3后充分搅拌,此烧杯中将会得到
A.悬浊液 B.饱和溶液
C.质量分数约为50%的溶液 D.物质的量浓度为10mol/L的溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
如何减少温室气体CO2的含量是科学家一直在探究的课题,最近中国科学技术大学的专家找到一种新型催化剂,可将CO2转化为液体燃料甲酸(CH2O2),下列说法中,不正确的是
A.地球上CO2含量上升的主要原因是植物的呼吸作用
B.CO2能吸收地面辐射,对地球有保温作用
C.CO2转化为甲酸的过程属于化学变化
D.这种新型催化剂在反应前后质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )| A. | 若甲为Na,则戊可能是H2O | B. | 若甲为C2H4,则戊可能是O2 | ||
| C. | 若甲为NO,则戊可能是H2O | D. | 若甲为Cl2,则戊可能是NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气具有还原性,可用于检查HCl泄漏 | |
| B. | 浓硫酸具有吸水性,可用于干燥CO2 | |
| C. | 铝具有高熔点,可用于生产耐火砖 | |
| D. | 硅有导电性,可用作光导纤维 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
对于某些离子的检验及结论正确的是
A.加入紫色石蕊试液,溶液变蓝,证明溶液中含有较多的H+
B.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-
C.加入稀硫酸后,生成能使澄清石灰水变浑浊的气体,可确定有大量的CO32-
D.加入盐酸酸化时无现象,再滴入BaCl2溶液,产生白色沉淀,可确定有SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com