
下列叙述不正确的是( )
A.根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量
B.CaCl2、MgCl2晶体都容易潮解,它们潮解的实质是晶体表面吸水形成溶液
C.根据金属活动性顺序表,可以推断冶炼金属时可能的方法
D.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行
科目:高中化学 来源: 题型:
一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 。
(2)在(1)中若充入的是2.5 mol CO(g)和4 mol H2 (g),达到平衡后混合气体的平均相对分子质量为 ;若要求达到平衡后混合气体的平均相对分子质量始终大于该值,则充入的CO、H2混合气体的总质量m和总物质的量n必须满足的关系为
查看答案和解析>>
科目:高中化学 来源: 题型:
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入正催化剂
A.①②③ B.②③⑤ C.②⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.25℃,某醋酸溶液的pH=a,将此溶液稀释到100倍后,溶液的pH=b,则a=b-2
B.在氨水的溶液中再加水,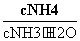 将变大
将变大
C.25℃ 0.5×10-3 mol/L硫酸的pH=3.0,升高温度溶液pH增大
D.25℃,浓度为0.1 mol/L盐酸溶液,水电离出的c(H+)为0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
a1,a2分别为A在两个恒容容器中平衡体系A(g) 2B(g) 和A(g)
2B(g) 和A(g) B(g)的转化率,在温度不变的情况下,均增加A(g)的物质的量,则 a1_______,a2______,(填“减小”或“增大”或“不变”)
B(g)的转化率,在温度不变的情况下,均增加A(g)的物质的量,则 a1_______,a2______,(填“减小”或“增大”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
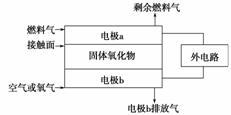
以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高的特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示,下列关于直接氨固体氧化物燃料电池的说法正确的是( )
A.该电池工作时的总反应为4NH3+5O2===4NO+6H2O
B.固体氧化物作为电池工作的电解质,其作用是让电子在电池内移动
C.电池工作时,在接触面上发生的电极反应为2NH3+3O2--6e-===N2+3H2O
D.外电路的电流方向为从电极a流向电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
运用有关概念判断下列叙述正确的是( )
A.1molH2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.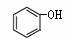 和
和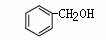 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH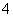 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO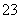 、SO
、SO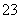 、SO
、SO 、Cl-、NO
、Cl-、NO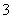 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
【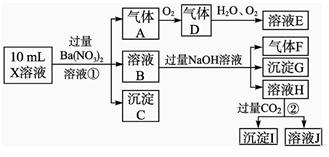 根据以上信息,回答下列问题:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com