
| A. | 0.2 mol/L 和0.1 mol/L的氨水中c(OH-)之比 | |
| B. | H2S溶液中c(H+)与c(S2-)之比 | |
| C. | Na2S溶液中c(Na+)与c(S2-)之比 | |
| D. | Na2O2晶体中阳离子与阴离子个数之比 |
分析 A.弱电解质溶液中,弱电解质的浓度越大,其电离程度越小,浓度越小,其电离程度越大;
B.第二步电离HS-?S2-+H+电离出c(H+)=c(S2-),而第一步电离程度远大于第二步电离;
C.在硫化钠中能电离出钠离子和硫离子,硫离子水解,导致硫离子浓度会减小;
D.根据Na2O2为离子化合物,既含有离子键,又含有共价键,阴、阳离子个数之比为1:2.
解答 解:A.一水合氨是弱电解质,在溶液里存在电离平衡,氨水的浓度越大,一水合氨的电离程度越小,浓度越小,一水合氨的电离程度越大,A瓶氨水的浓度是B瓶氨水的浓度的2倍,因弱电解质的浓度越小,电离程度越大,故A瓶氨水的电离度比B瓶氨水的电离度小,所以A、B两瓶氨水中[OH-]之比小于2,故A错误;
B.第二步电离HS-?S2-+H+电离出c(H+)=c(S2-),而第一步电离程度远大于第二步电离,所以溶液中c(H+)>2c(S2-),故B错误;
C.硫化钠中能电离出钠离子和硫离子,电离出的钠离子浓度应是硫离子浓度的2倍,但是硫离子一部分会水解,导致硫离子浓度会减小,所以c(Na+):c(S2-)>2:1,故C错误;
D.Na2O2为离子化合物,是由钠离子和过氧根离子构成的离子化合物,阳离子与阴离子个数之比为2:1,故D正确,
故选D.
点评 本题考查了弱电解质电离、盐类水解,明确弱电解质电离特点是解本题关键,难度中等,需要注意的是Na2O2为离子化合物,阴、阳离子个数之比为1:2.


科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器盛有0.1molN2和0.3molH2,充分反应后,形成的N-H键数目为0.6NA | |
| B. | 若由CO2和O2组成的混合物共有NA个分子,则其中所含的氧原子数为2NA | |
| C. | 常温下,1L0.1mol/LNH4NO3溶液中的氢原子数为0.4NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体(标况下)时,电路中通过的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
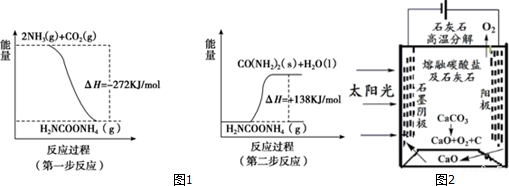
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
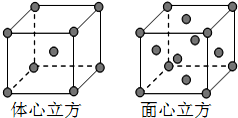 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过分馏可得到焦炭、煤焦油和焦炉气 | |
| B. | 石油裂化是为了获得更多的汽油 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 甲烷、汽油、酒精都是可燃性烃,都可作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
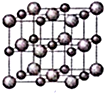 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
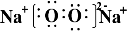 ,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、
,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、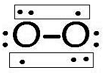 ,其分子空间构型为直线型.
,其分子空间构型为直线型.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应/K/温度 | 458K 478K 488K |
| ① ② ③ | 1.78×104 1.43×104 1.29×104 1.91×107 1.58×107 1.45×107 8.11×108 3.12×108 2.00×108 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com