
�⼰�仯�����ںϳ�ɱ������ҩ��ȷ�����й㷺��;���ش��������⣺
��1�������ĵ⸻���ں����У���ˮ��ȡ��Ũ��������Ũ��Һ�м�MnO2��H2SO4�����ɵõ�I2���÷�Ӧ�Ļ�ԭ����Ϊ____________��
��2������Ũ��Һ�к���I-��Cl-�����ӣ�ȡһ������Ũ��Һ�������еμ�AgNO3��Һ����AgCl��ʼ����ʱ����Һ��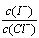 Ϊ��_____________����֪Ksp��AgCl��=1.8��10-10��Ksp��AgI��=8.5��10-17��
Ϊ��_____________����֪Ksp��AgCl��=1.8��10-10��Ksp��AgI��=8.5��10-17��
��3����֪��Ӧ2HI(g) ===H2(g) + I2(g)�Ħ�H= +11kJ��mol��1��1mol H2(g)��1mol I2(g)�����л�ѧ������ʱ�ֱ���Ҫ����436kJ��151kJ����������1molHI(g)�����л�ѧ������ʱ�����յ�����Ϊ______________kJ��
��4��Bodensteins�о������з�Ӧ��
2HI(g) H2(g) + I2(g)
H2(g) + I2(g)
��716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
�� ��������ʵ�������÷�Ӧ��ƽ�ⳣ��K�ļ���ʽΪ��___________��
�� ������Ӧ�У�����Ӧ����Ϊv��= k����x2(HI)���淴Ӧ����Ϊv��=k����x(H2)��x(I2)������k����k��Ϊ���ʳ�������k��Ϊ________(��K��k����ʾ)����k�� = 0.0027min-1����t=40minʱ��v��=__________min-1
�� ������ʵ�����ݼ���õ�v��~x(HI)��v��~x(H2)�Ĺ�ϵ������ͼ��ʾ�������ߵ�ijһ�¶�ʱ����Ӧ�� �´ﵽƽ�⣬��Ӧ�ĵ�ֱ�Ϊ_________________������ĸ��
�´ﵽƽ�⣬��Ӧ�ĵ�ֱ�Ϊ_________________������ĸ��

���𰸡���1��MnSO4��
��2�� 4.7��10-7��
��3�� 299
��4����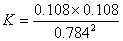 ����k��= k��/K ��1.95��10-3���� A��E
����k��= k��/K ��1.95��10-3���� A��E
����������1�����и���������ԭ��Ӧ����ʽ���жϻ� ԭ��������ѧ���濼����Ǩ��ʵ������������ԭ���ɵ�MnSO4��
ԭ��������ѧ���濼����Ǩ��ʵ������������ԭ���ɵ�MnSO4��
��2�� ��ϵ�м����Ȼ������е⻯��ʱ�����ڳ���ת��ƽ�⣺AgI(s) +Cl�� AgCl(s) +I����
AgCl(s) +I����
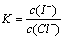
���ӡ���ĸͬʱ����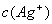 ���У�
���У�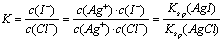 ����Ksp��AgCl��=1.8��10-10��Ksp��AgI��=8.5��10-17����ã�
����Ksp��AgCl��=1.8��10-10��Ksp��AgI��=8.5��10-17����ã�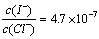 ��
��
��3�� ����һ��ȡ��ֵ�����㣬��H=E����Ӧ������ܺͣ���E������������ܺͣ�����1molHI��g�������л�ѧ������ʱ�����յ�����ΪxkJ��������㣺+11=2x����436+151��
x =299
��4�� �����еķ�Ӧ�DZȽ�����ģ���Ӧǰ�����������ȣ���ͬ����ʼ̬�����״ﵽ��Ч��ƽ��״̬�����ע������е����������������������������ݡ�
716Kʱ��ȡ��һ�����ݼ��㣺2HI��g�� H2��g��+I2��g��
H2��g��+I2��g��
n��ʼ����ȡ1mol�� 1 0 0
��n ��0.216�� ��0.108�� ��0.108��
n��ƽ�� 0.784 ��0.108�� ��0.108��
��ѧƽ�ⳣ��Ϊ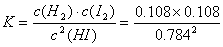
��С���״��㣺����ʽ�ᱻ����Ϊ�DZ���ʽ��
���ʵ�Ҫ���ǣ�ƽ��״̬�£�v��= v�������У�k����x2(HI) = k����x(H2)��x(I2)
����k��/ k��=�� x(H2)��x(I2)��/ x2(HI)=K
���� k��= k��/K
�� �ʿ��ƺ��ѣ���ʵע����µ�����ЧӦ���ӿ컯ѧ��Ӧ���ʡ�ʹƽ���ƶ�������ͻ�ƣ��ȿ�ͼ���Ұ���������Ӧ�����ʼӿ죬���������ƣ�ƽ�⣨������֪����Ӧ���ȣ������ƶ������������ơ���ǰ�������ҳ�A�㡣ͬ�����ҳ�E�㡣
�����㶨λ����ѧƽ�ⳣ�����㣻��ѧƽ��֪ʶ���ۺ����ã��������ڸ���ƽ��֪ʶ���ۺ����ã������Ѷ�Ϊ���ѵȼ���
����ʦ���硿����ƫ�ѡ�ǰ��С�����dz��濼�㣬�Ѷ�Ϊһ��ȼ������һС�⸳��10�֣��Ѷ�ƫ�����������������龰����4���ʢ�С���������ö����Dz��֣��ؼ���Ҫ�ǵ�ƽ���־֮һ����v��= v�����ҵ�k����k����K����ϵ����ͻ�ơ���4���ʢ�С�ʵ�ͼ��Ҫ�ܿ���ʶ������������淴Ӧ������x(H2)�ı仯���ұ�����������Ӧ������x(HI)�ı仯����ϸ������ͼ�������ѱ���v����v��������Ҳ�ɰ������ķ�������������Ȼ������������ǹ��õģ������������ߺ�����ĺ����Dz�ͬ�ġ�����ƽ���ƶ����º�����仯ʱһ��Ҫע����һ�㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�ּ���Ⱦ�ϣ�Ӧ���ڿɵ�гȾ�ϼ�����������C��H��O����Ԫ����ɣ��������ģ����ͼ��ʾ�������й�������ȷ����(����)
�ٷ���ʽΪC10H9O3���ڲ�������ˮ����1 mol�������������4 mol H2�ӳɡ�����ʹ����KMnO4��Һ��ɫ����1 mol������������뺬2 mol NaOH����Һ��Ӧ
A���٢ڢ� B���ۢܢ�
C���ڢۢ� D���ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�˵����ȷ����
A��SiO2���������������SiO2����NaOH��Һ��Ӧ
B��SO2����ʹ��ˮ��ɫ������SO2����Ư����
C����ij������Һ����ɫ��Ӧ�ʻ�ɫ�������Һ������һ��ΪNaOH
D��NH3��ˮ��Һ���Ե��磬����NH3�ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25��ʱ����10mLŨ�Ⱦ�Ϊ0.1mol/LNaOH��NH3��H2O�����Һ�У��μ�0.1mol/L�����ᣬ�����й���Һ������Ũ�ȹ�ϵ��ȷ���ǣ� ��
A��δ������ʱ��c(OH��)��c(Na��)= c(NH3��H2O)
B������10mL����ʱ��c(NH4��) ��c(H��) �� c(OH��)
C��������������ҺpH=7ʱ��c(Cl��) = c(Na��)
 D������20mL����ʱ��c(Cl��) ��c(NH4��) ��c(Na��)
D������20mL����ʱ��c(Cl��) ��c(NH4��) ��c(Na��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����(��Ҫ��Ⱦ��SO2��NOx)��O3Ԥ��������CaSO3ˮ����Һ���գ��ɼ���������SO2��NOx�ĺ�����O3����������SO2��NOx����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ��
NO(g)��O3(g)=NO2(g)��O2(g) ��H=��200��9kJ��mol��1
NO(g)��1/2O2(g)=NO2(g) ��H=��58��2kJ��mol��1
SO2(g)��O3(g)=SO3(g)��O2(g) ��H=��241��6kJ��mol��1
��1����Ӧ3NO(g)��O3(g)=3NO2(g)�ġ�H=_______mol��L��1��
��2�������£��̶����뷴Ӧ����NO��SO2�����ʵ������ı����O3�����ʵ�������Ӧһ��ʱ�����ϵ��n(NO)��n(NO2)��n(SO2)�淴Ӧǰn(O3)��n(NO)�ı仯����ͼ��
�ٵ�n(O3)��n(NO)>1ʱ����Ӧ��NO2�����ʵ������٣���ԭ����__________��
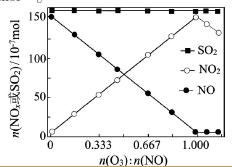 ������n(O3)��O3����SO2�ķ�Ӧ��������Ӱ�죬�����ԭ���� _________��
������n(O3)��O3����SO2�ķ�Ӧ��������Ӱ�죬�����ԭ���� _________��
��3������CaSO3ˮ����Һ���վ�O3Ԥ����������ʱ����Һ(pHԼΪ 8)��SO32����NO2ת��ΪNO2���������ӷ���ʽΪ��___________��
��4��CaSO3ˮ����Һ�м���Na2SO4��Һ���ﵽƽ�����Һ��c(SO32��)=________[��c(SO42��)��Ksp(CaSO3)��Ksp(CaSO4)��ʾ]��CaSO3ˮ����Һ�м���Na2SO4��Һ�����NO2���������ʣ�����Ҫԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ڲ�ͬŨ�ȣ�c)���¶ȣ�T)�����£�����ˮ���˲ʱ���ʣ�v�����±��������жϲ���ȷ���ǣ� ��
|
| 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
A��a=6.00 B��ͬʱ�ı䷴Ӧ�¶Ⱥ����ǵ�Ũ�ȣ�v���ܲ���
C��b��318.2 D����ͬ�¶�ʱ������Ũ�ȼ���һ�������ʱ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ϊ̽�ֻ�ѧƽ���ƶ�ԭ����������ԭ��Ӧ���ɵ���ϵ��ijͬѧͨ���ı�Ũ���о���2Fe3++2I- 2Fe2++I2����Ӧ��Fe3+��Fe2+���ת����ʵ�����£�
2Fe2++I2����Ӧ��Fe3+��Fe2+���ת����ʵ�����£�
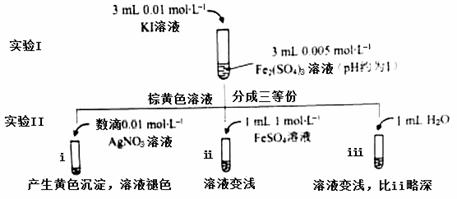
��1����ʵ��I��Һ��ɫ���ٸı�ʱ���ٽ���ʵ��II��Ŀ����ʹʵ��I�ķ�Ӧ�ﵽ ��
��2��iii��ii�ĶԱ����飬Ŀ�����ų���ii�� ��ɵ�Ӱ�졣
��3��i��ii����ɫ�仯����ƽ�������ƶ���Fe2+��Fe3+ת�����û�ѧƽ���ƶ�ԭ������ԭ�� ��
��4������������ԭ��Ӧ�Ĺ��ɣ���ͬѧ�Ʋ�i��Fe2+��Fe3+ת����ԭ�����Ag+ʹc(I-)���ͣ�����I-�Ļ�ԭ������Fe2+������ͼװ�ã�a��b��Ϊʯī�缫������ʵ����֤��
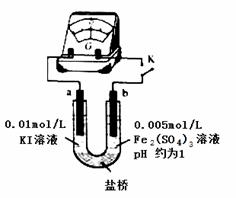
��K�պ�ʱ��ָ������ƫת��b�� ����
�ڵ�ָ����㣨��Ӧ�ﵽƽ�⣩����U����ܵμ�0.01 mol/L AgNO3��Һ������������֤ʵ�����Ʋ⣬�������� ��
��5�����գ�4����ԭ������ͬѧ����ͼװ�ý���ʵ�飬֤ʵ��ii��Fe2+��Fe3+ת����ԭ��
��ת��ԭ���� ��
���루4��ʵ��Աȣ���ͬ�IJ����� ��
��6��ʵ��I�У���ԭ�ԣ�I->Fe2+����ʵ��II�У���ԭ�ԣ�Fe2+>I-������3���ͣ�4������5�����Աȣ��ó��Ľ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���У��ٴ�����̼����ag����̼������̼�����ƵĻ����ag��������ȣ����и��������������ȷ���ǣ���
| A�� | �ֱ��������ȫ��Ӧʱ�������ĺ������� | |
| B�� | �ֱ��������ȫ��Ӧʱ��������̼���Ʒų���CO2�� | |
| C�� | �ֱ�����ˮ���ټ�����������ʯ��ˮ�������õ��ij��������� | |
| D�� | �ֱ���ɵ��������Һ���������Һ��Na+�����ʵ���Ũ�ȴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�����ȼ���ȡ�H=-2215KJ��mol-1����һ�����ı�����ȫȼ�պ�����1.8gˮ����ų�������ԼΪ�� ��
A��55 kJ B��220 kJ C�� 550 kJ D��1108 kJ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com