
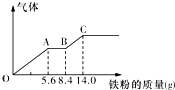
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A. | H2SO4浓度为2.5 mol•L-1 | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| C. | 第二份溶液中最终溶质为FeSO4 | |
| D. | 原混合酸中NO3-物质的量为0.1 mol |
分析 由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑;
A.加入Fe粉14gL时,完全反应,此时溶液中溶质为FeSO4,根据守恒可知n(FeSO4)=n(H2SO4),进而确定硫酸的浓度;
B.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
C.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸;
D.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
解答 解:A.加入Fe粉14g时,完全反应,此时溶液中溶质为FeSO4,反应消耗铁的物质的量=$\frac{14g}{56g/mol}$=0.25mol,根据守恒可知n(H2SO4)=n(FeSO4)=n(Fe)=0.25mol,所以硫酸的浓度是$\frac{0.25mol}{0.1L}$=2.5mol/L,故A正确;
B.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;
C.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故C正确;
D.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,每份溶液中n(NO3-)=n(Fe),所以原混合酸中n(NO3-)=n(HNO3)=2n(Fe)=2×$\frac{5.6g}{56g/mol}$=0.2mol,故D错误;
故选:D.
点评 本题以化学反应图象为载体,考查有关金属和酸反应的计算,难度较大,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用为易错点.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖的分子式是C6H12O6 | B. | 葡萄糖属于有机高分子化合物 | ||
| C. | 葡萄糖是人体重要的能量来源 | D. | 葡萄糖能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用高纯硅可以制成光电池,将光能直接转化为电能 | |
| B. | CO、CO2均易于血红蛋白结合而中毒 | |
| C. | SiO2可用于制造光导纤维和半导体 | |
| D. | SiO2和H2O反应可直接制备H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.
三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.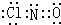 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
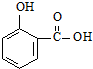 )的沸点与对羟基苯甲酸(
)的沸点与对羟基苯甲酸(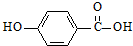 )的沸点相同是由于它们互为同分异构体不正确;邻羟基苯甲醛分子内的羟基与醛基之间即存在氢键(分子内氢键),而对羟基苯甲醛分子之间存在氢键(分子间氢键),与互为同分异构体无关.
)的沸点相同是由于它们互为同分异构体不正确;邻羟基苯甲醛分子内的羟基与醛基之间即存在氢键(分子内氢键),而对羟基苯甲醛分子之间存在氢键(分子间氢键),与互为同分异构体无关.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
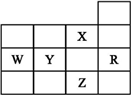
| A. | W元素气态氢化物较Y元素的气态氢化物稳定 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | p能级未成对电子最多的是Z元素 | |
| D. | X元素是非金属性最强的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com